Методические указания по аналитической химии: расчёты при приготовлении растворов и определении результатов титриметрического анализа


CМинистерство образования Российской Федерации
Томский политехнический университет
УТВЕРЖДАЮ
Декан ХТФ
В. М. _Погребенков
«» 2007 г.
АНАЛИТИЧЕСКАЯ ХИМИЯ
РАСЧЕТЫ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРОВ И
ОПРЕДЕЛЕНИИ РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКОГО
АНАЛИЗА
Методические указания и варианты контрольных заданий
к самостоятельной работе студентов по дисциплине
« Аналитическая химия» для студентов ХТФ направления
550800- «Химическая технология и биотехнология»
Томск 2007
УДК 543
Дубова Н. М. Аналитическая химия. Расчеты при приготовлении растворов и определении результатов титриметрического анализа. Методические указания и варианты контрольных заданий к самостоятельной работе студентов ХТФ направления 550800 . - Томск: Изд-во ТПУ, 2007. - 24 с.
Составитель доц., к. х. н. H. M. Дубова
Рецензент
доц., к. х. н. кафедры ФАХ Е. И. Короткова
Методические указания рассмотрены и рекомендованы к изданию методическим семинаром кафедры физической и аналитической химии № 1 от 1 сентября 2007г.
Зав. кафедрой ФАХ _ А. А. Бакибаев
Одобрено учебно-методической комиссией ХТФ
Председатель учебно-методической комиссии
Н. В. Ушева
РАСЧЕТЫ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРОВ И
ОПРЕДЕЛЕНИИ РЕЗУЛЬТАТОВ АНАЛИЗА
Если вещество удовлетворяет требованиям, предъявляемым к стандартным или исходным веществам, то из него можно приготовить рабочий раствор с точно известной концентрацией путем растворения точной навески вещества (m) в мерной колбе (V) .
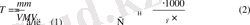
В случае, когда вещество не удовлетворяет требованиям, предъявляемым к стандартным веществам, готовят рабочий раствор приблизительной концентрации, а точную концентрацию устанавливают по стандартному веществу, используя метод пипетирования или метод отдельных навесок (формулы 3; 5)
- метод пипетирования

С Н (А), С Н (В) - молярные концентрации эквивалентов стандартного (А) и рабочего (В) растворов;
V(A), V(B) - объемы стандартного и рабочего растворов при титровании;
m(A) - навеска стандартного вещества (А) ;
М э (А) - молярная масса эквивалента вещества (А)
- метод отдельных навесок
При приготовлении растворов (например, кислот и оснований) используется разбавление.
Пример 1.
Сколько миллилитров конц. H 2 SO 4 (ρ=1, 49 г/см 3 ), содержащей 60% H 2 SO 4 , нужно взять для приготовления 500 мл 0, 1 н. раствора?
Решение:
1. Вычислим молярную концентрацию эквивалента концентрированной H 2 SO 4 :
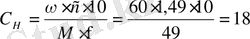 н
н
2. Если раствор разбавлять, то его объем и концентрация будут изменяться, но общее количество эквивалентов растворенного вещества останется постоянным. Поэтому при разбавлении, как и при титровании, справедливо равенство:
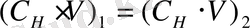 . Применяя его к рассматриваемому случаю, получим:
. Применяя его к рассматриваемому случаю, получим:
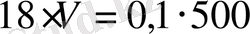 , откуда
V
конц
(H
2
SO
4
) =3 мл.
, откуда
V
конц
(H
2
SO
4
) =3 мл.
Пример 2.
Рассчитать, какой объем 3 н H 2 SO 4 следует прибавить к 1 л 0, 6 н H 2 SO 4 , чтобы получить 1, 5 н раствор?
Решение:
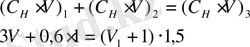
Решив полученное уравнение, получим V =600 мл.
РАСЧЕТЫ РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
В титриметрическом анализе рассчитывают массу определяемого вещества по известным объемам реагирующих веществ и известной концентрации одного или нескольких рабочих растворов.
- Прямое титрование- наиболее распространенный и удобный прием, когда к анализируемому раствору добавляют рабочий раствор.
Массу определяемого вещества m(A) определяют в данном случае по формуле (6)
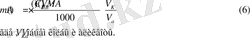
- Титрование заместителя(косвенный метод) применяют, когда нет подходящей реакции или индикатора для прямого тестирования. В этом случае используют какую-либо реакцию, в которой анализируемое вещество замещают эквивалентным количеством другого вещества, а последнее титруют рабочим раствором. Массу определяемого веществаm(A) рассчитывают по формуле (6) .
- Обратное титрование(титрование остатка) используют в тех случаях, когда прямое титрование невозможно или когда анализируемое вещество неустойчиво. При этом применяют два рабочих раствора. К раствору определяемого вещества (А) добавляют избыток рабочего раствора (В), а когда реакция заканчивается, остаток В титруют рабочим раствором С.
Таким образом, масса определяемого вещества (А) рассчитывается в этом случае по формуле:
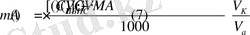
Пример 3.
При определении содержания CaO в образце мела навеску в 0, 1500 г обработали 50, 00 мл 0, 0999 М HCI, избыток кислоты оттитровали 10, 00 мл NaOH (К=1, 01) . Вычислить массовую долю CaO в образце мела.
Решение:
Из условия задачи видно, что определение CaO проводилось методом обратного титрования. Поэтому для расчета массы CaO в образце мела выбираем формулу (7) :

При выполнении расчетов следует учитывать некоторые математические правила. Если точность анализа не ограничивается заранее, то следует иметь в виду, что концентрация вычисляется до четвертой значащей цифры после запятой, процентное содержание - до сотых долей. Каждый результат не может быть точнее, чем это позволяют измерительные приборы, и математическими расчетами точность анализа повысить нельзя. Лишние цифры рекомендуется округлять.
ПРИ ПРИГОТОВЛЕНИИ РАСТВОРОВ И
ОПРЕДЕЛЕНИИ РЕЗУЛЬТАТОВ АНАЛИЗА
Если вещество удовлетворяет требованиям, предъявляемым к стандартным или исходным веществам, то из него можно приготовить рабочий раствор с точно известной концентрацией путем растворения точной навески вещества (m) в мерной колбе (V) .
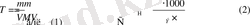
В случае, когда вещество не удовлетворяет требованиям, предъявляемым к стандартным веществам, готовят рабочий раствор приблизительной концентрации, а точную концентрацию устанавливают по стандартному веществу, используя метод пипетирования или метод отдельных навесок (формулы 3; 5)
- метод пипетирования

С Н (А), С Н (В) - молярные концентрации эквивалентов стандартного (А) и рабочего (В) растворов;
V(A), V(B) - объемы стандартного и рабочего растворов при титровании;
m(A) - навеска стандартного вещества (А) ;
М э (А) - молярная масса эквивалента вещества (А)
- метод отдельных навесок
При приготовлении растворов (например, кислот и оснований) используется разбавление.
Пример 1.
Сколько миллилитров конц. H 2 SO 4 (ρ=1, 49 г/см 3 ), содержащей 60% H 2 SO 4 , нужно взять для приготовления 500 мл 0, 1 н. раствора?
Решение:
1. Вычислим молярную концентрацию эквивалента концентрированной H 2 SO 4 :
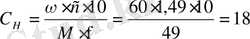 Equation. 3 н
Equation. 3 н
2. Если раствор разбавлять, то его объем и концентрация будут изменяться, но общее количество эквивалентов растворенного вещества останется постоянным. Поэтому при разбавлении, как и при титровании, справедливо равенство:
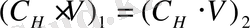 . Применяя его к рассматриваемому случаю, получим:
. Применяя его к рассматриваемому случаю, получим:
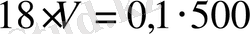 , откуда
V
конц
(H
2
SO
4
) =3 мл.
, откуда
V
конц
(H
2
SO
4
) =3 мл.
Пример 2.
Рассчитать, какой объем 3 н H 2 SO 4 следует прибавить к 1 л 0, 6 н H 2 SO 4 , чтобы получить 1, 5 н раствор?
Решение:
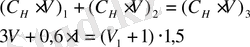
Решив полученное уравнение, получим V =600 мл.
РАСЧЕТЫ РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
В титриметрическом анализе рассчитывают массу определяемого вещества по известным объемам реагирующих веществ и известной концентрации одного или нескольких рабочих растворов.
- Прямое титрование- наиболее распространенный и удобный прием, когда к анализируемому раствору добавляют рабочий раствор.
Массу определяемого вещества m(A) определяют в данном случае по формуле (6)
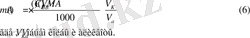
- Титрование заместителя(косвенный метод) применяют, когда нет подходящей реакции или индикатора для прямого тестирования. В этом случае используют какую-либо реакцию, в которой анализируемое вещество замещают эквивалентным количеством другого вещества, а последнее титруют рабочим раствором. Массу определяемого веществаm(A) рассчитывают по формуле (6) .
- Обратное титрование(титрование остатка) используют в тех случаях, когда прямое титрование невозможно или когда анализируемое вещество неустойчиво. При этом применяют два рабочих раствора. К раствору определяемого вещества (А) добавляют избыток рабочего раствора (В), а когда реакция заканчивается, остаток В титруют рабочим раствором С.
Таким образом, масса определяемого вещества (А) рассчитывается в этом случае по формуле:
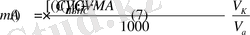
Пример 3.
При определении содержания CaO в образце мела навеску в 0, 1500 г обработали 50, 00 мл 0, 0999 М HCI, избыток кислоты оттитровали 10, 00 мл NaOH (К=1, 01) . Вычислить массовую долю CaO в образце мела.
Решение:
Из условия задачи видно, что определение CaO проводилось методом обратного титрования. Поэтому для расчета массы CaO в образце мела выбираем формулу (7) :

При выполнении расчетов следует учитывать некоторые математические правила. Если точность анализа не ограничивается заранее, то следует иметь в виду, что концентрация вычисляется до четвертой значащей цифры после запятой, процентное содержание - до сотых долей. Каждый результат не может быть точнее, чем это позволяют измерительные приборы, и математическими расчетами точность анализа повысить нельзя. Лишние цифры рекомендуется округлять.
ЛИТЕРАТУРА
- В. П. Васильев. Аналитическая химия, 1989, М. : Высшая школа, ч. 1, - 320 с.
- Ю. А. Золотов. Основы аналитической химии. М. : Высшая щкола, 1999-351с.
Вариант №1
- К 55, 00 мл 0, 1925 М HCl прибавили 50, 00 мл раствора HCl с Т=0, 02370 г/мл. Вычислить молярную концентрацию и титр полученного раствора.
- Вычислить молярную концентрацию и титр раствора HCl, если на титрование 0, 4217 г буры израсходовано 17, 50 мл этой кислоты.
- К раствору, содержащему NH4NO3добавили 20 мл 0, 1 н раствора NaOH. После нагревания (удаления выделившегося NH3), остаток NaOH оттитровали 5 мл 0, 1 н. HCl. Вычислить содержание NH4NO3в растворе.
- К навеске 0, 1275 г K2Cr2O7прибавили избыток КУ и выделившийся I2оттитровали 22, 85 мл Na2S2O3. Определить Т(Na2S2O3/I2) и молярную концентрацию раствора тиосульфата натрия.
Вариант №2
- Какой объем 4, 000 М HCl надо прибавить к 500, 0 мл раствора HCl с Т(HCl/CaO) =0, 08400 г/мл, чтобы получить раствор с Т(HCl/CaO) =0, 09000 г/мл?
- Навеску H2C2O4⋅2H2O массой 0, 6000 г растворили в мерной колбе вместимостью 100, 0 мл. На титрование 20, 00 мл полученного раствора израсходовали 18, 34 мл NaOH. Определить молярную концентрацию раствора NaOH и его титр по H2C2O4.
- Хром, содержащийся в 1, 87 г технического хромита (FeO⋅Cr2O3) окислили до шестивалентного состояния () . После подкисления к раствору добавили 50 мл 0, 160 н. раствора. На титрование остаткаизрасходовано 2, 97 мл 0, 0500 н. раствора K2Cr2O7. Каково % содержание хрома в образце?
- Для стандартизации раствора тиосульфата натрия 0, 1000 г KBrO3растворили в разбавленной HCl, добавили избыток КУ и выделившийся йод оттитровали, израсходовав 39, 7 мл тиосульфата натрия. Рассчитать нормальную концентрацию Na2S2O3.
Вариант №3
- Какой объем HClω=38, 32% (ρ=1, 19 г/см3) необходим для приготовления 500 мл 0, 1 М раствора?
- Навеску щелочи массой 0, 5341 г, содержащей 92, 00% NaOH и 8, 00% индифферентных примесей, растворили в мерной колбе вместимостью 100, 0 мл. На титрование 20, 00 мл полученного раствора израсходовали 18, 34 мл HCl. Определить молярную концентрацию кислоты и Т(HCl/NaOH), если на титрование 15, 00 мл раствора израсходовано 19, 5 мл кислоты.
- Образец окиси цинка массой 202, 9 мг растворен в 50, 00 мл 0, 976 0н H2SO4, остаток кислоты оттитрован 31, 95 мл 1, 372 н. NaOH. Вычислить % содержание чистой окиси цинка в образце.
- Для стандартизации раствора тиосульфата натрия 0, 1510 г K2Cr2O7растворили в разбавленной HCl, добавили избыток КI и выделившийся йод оттитровали, израсходовав 46, 1 мл реагента. Рассчитайте нормальную концентрацию Na2S2O3.
Вариант №4
- Сколько мл 10 н. HCl необходимо добавить к 500 мл 0, 1 н. раствора, чтобы получить 1 н. раствор HCl?
- До какого объема нужно довести раствор, в котором содержится 1, 532 г NaOH, чтобы на титрование его аликвоты в 20, 00 мл израсходовать 14, 70 мл HCl. Т(HCl) =0, 003800 г/мл.
- Найти % содержание MnO2в пиролюзите, если образец его в 153, 0 мг обработан 30 мл 0, 1075 н. раствора щавелевой кислоты и разбавленной серной кислотой. Остаток щавелевой кислоты требует для титрования 5, 31 мл раствора KMnO4, 1 мл которого эквивалентен 1, 025 мл H2C2O4.
- Из 100 г KOH, содержащего 0, 5% индифферентных примесей, приготовлен 1 л раствора. Вычислить молярную концентрацию и титр раствора по H3PO4.
Вариант №5
- Сколько мл 20 % H2SO4(ρ=1, 135 г/мл) необходимо взять для приготовления 1 л 0, 1 н. раствора (f (H2SO4) =1/2) ?
- Какой объем 0, 1 н. K2Cr2O7достаточен для окисленияиз навески концентрата в 0, 2000 г, содержащего 50% железа?
- При определении магния в шлаке он был выделен в виде осадка MgNH4PO4, который был растворен в 50 мл 0, 2000 н. HCl по реакции:
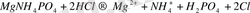
Oстаток кислоты оттитровали щелочью таким образом, чтобы не реагировали ионы
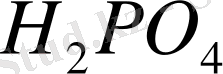 . На оттитрование остатка кислоты пошло 10 мл 0, 2500 н. NaOH. Вычислить % содержание магния в шлаке, если навеска сплава 1. 000 г .
. На оттитрование остатка кислоты пошло 10 мл 0, 2500 н. NaOH. Вычислить % содержание магния в шлаке, если навеска сплава 1. 000 г .
- Навеску 5, 8542 г хлористого натрия растворили в 1 л воды. Вычислить молярную концентрацию приготовленного раствора и титр его по серебру.
Вариант №6
- Сколько мл 20% H2SO4следует прибавить к 1000 мл 0, 08 н раствора H2SO4, чтобы получить 0, 20 н раствор?
- Какой объем 0, 1 н KMnO4достаточен для окисленияиз навески концентрата в 0, 4000 г, содержащего 48% железа.
- При определении азота в органическом веществе азот из навески в 0, 5000 г переведен в NH3и перегнан в 50 мл 0, 1000 н HCl. Остаток HCl оттитрован 15 мл 0, 1200 н NaOH. Вычислить % содержание азота в веществе.
- Сколько грамм щелочи, содержащей 96, 5 % КОН и 4, 5% индифферентных примесей, следует взять для приготовления 1 литра 0, 1 н раствора щелочи.
Вариант №7
- Какой объем 0, 5000 н. KMnO4(f=1/5) необходимо прибавить к 500, 0 мл раствора с Т(KMnO4/Fe2+) = 0, 00280 г/мл, чтобы получить раствор с титром перманганата калия Т = 0, 00280 г/мл.
- На титрование раствора, полученного из навески щавелевой кислоты массой 0, 1371 г израсходовано 22, 10 мл 0, 09842 М NaOH. Сколько молекул кристаллизационной воды содержалось в исходном препарате кислоты?
- В навеске стали 1, 075 г хром был окислен до. Затем было добавлено с избытком 25, 0 мл раствора Fe SO4и непрореагировавший остаток Fe SO4оттитрован 3, 7 мл KMnO4. Известно, что Т(KMnO4/Equation. 3 ) =0, 000710 г/мл и что 25 мл раствора FeSO4эквивалентны 25, 82 мл раствора KMnO4.
- Раствор КОН содержит 26, 34% щелочи. Вычислить, сколько литров 0, 1 н. раствора можно приготовить из 1 л этого раствора.
Вариант №8
- До какого объема следует разбавить 500, 0 мл 0, 1000 н K2Cr2O7(f=1/5) , чтобы получить раствор с Т(K2Cr2O7) =0, 003922 г/мл.
- Какую массу щавелевой кислоты H2C2O4⋅2H2O нужно взять, чтобы на ее титрование расходовалось 20, 00 мл 0, 1 М NaOH?
- Какая масса кальция содержится в 250, 00 мл раствора CaCl2, если после прибавления к 25, 00 мл его 40, 00 мл 0, 1000 н. (NH4) 2C2O4(f=1/2) и отделения образовавшегося осадка CaC2O4⋅2H2O, на титрование остатка (NH4) 2C2O4израсходовали 15, 00 мл 0, 02000 н. KMnO4(f=1/5) .
- Рассчитать массовую долю (%) меди в руде, если из навески руды массой 0, 6215 г медь перевели в раствор в виде Cu2+, добавили к этому раствору избыток KI и на титрование выделившегося I2израсходовали 18, 23 мл раствора тиосульфата натрия с Т(Na2S2O3/Cu2+) = 0, 006408 г/мл.
Вариант №9
- Какой объем 0, 5000 н. KMnO4(f=1/5) необходимо прибавить к 500 мл раствора с Т(KMnO4/Fe2+) =0, 00280 г/мл, чтобы получить раствор с Т(KMnO4/Fe2+) =0, 00480 г/мл?
- На титрование раствора, содержащего 3, 158 г технического КОН, израсходовали 27, 35 мл раствора HCl, Т(HCl/NaOH) =0, 07862 г/мл. Вычислить массовую долю (%) КОН в образце.
- К раствору KClO3прибавили 50, 00 мл 0, 1048 М раствора FeSO4, избыток которого оттитровали 20, 00 мл 0, 09450 н. KMnO4(f=1/5) . Какая масса KClO3содержалась в растворе?
- На титрование 0, 08425 г H2C2O4⋅2H2O потребовалось 20, 2 мл раствора едкого натра. Вычислить молярную концентрацию раствора едкого натра и его титр по CH3COOH.
Вариант №10
- До какого объема следует разбавить 50, 00 мл 0, 1000 М K2Cr2O7(f=1/6), чтобы получить раствор с Т(K2Cr2O7/Fe2+) =0, 005000 г/мл.
- Навеску неизвестного вещества массой 2, г растворили в мерной колбе вместимостью 100, 0 мл. На титрование 25, 00 мл раствора израсходовали 20, 00 мл 0, 4455 М HCl. Определить, что входило в состав анализируемого вещества: КОН или NaOH?
- К навеске 0, 0735 г дихромата калия добавили избыток раствора KI в кислой среде. Выделившийся J2оттитровали 15, 05 мл раствора тиосульфата натрия. Определить молярную концентрацию Na2S2O3и Т(Na2S2O3/I2) .
- На титрование 0, 1000 г H2C2O4⋅2H2O потребовалось 10, 0 мл раствора едкого кали. Вычислить титр и молярную концентрацию едкого кали (f(H2C2O4⋅2H2O) =1/2) .
Вариант №11
- Сколько мл 10% HCl (ρ=1, 05 г/мл) необходимо взять, чтобы приготовить 100 мл 0, 01 н раствора?
- На титрование с фенолфталеином смеси, состоящей из Na2CO3, NaHCO3и NaCl массой 0, 4478 г потребовалось 18, 80 мл 0, 1998 М раствора HCl. На титрование с метиловым оранжевым на ту же навеску израсходовали 40, 00 мл раствора кислоты. Вычислить массовую долю (%) Na2CO3и NaHCO3в образце. Ответ: 88, 91% Na2CO3, 9, 00% NaHCO3.
- К раствору, содержащему 0, 1510 г технического KClO3, прилили 100, 0 мл 0, 0985 н раствора Na2C2O4( f=1/2 ), остаток которого оттитровали 22, 60 мл 0, 1146 н. KMnO4(f=1/5) . Вычислить массовую долю (%) KClO3в образце.
- Навеску 0, 5850 г NaCl растворили в 1 л H2O. Вычислить титр и молярную концентрацию эквивалента полученного раствора.
Вариант №12
- Сколько мл 8 н HNO3необходимо добавить к 500 мл 0, 1 н раствора, чтобы получить 0, 8 н раствор?
- Какую массу руды, содержащей около 60% Fe2O3, следует взять для анализа, чтобы после соответствующей обработки на титрование полученной соли железа (II) израсходовать 20, 00 мл 0, 1 н. раствора KMnO4(f (KMnO4) =1/5) . (Ответ 0, 27 г) .
- В каком объеме соляной кислоты Т(HCl) =0, 003638 г/мл нужно растворить навеску CaCO3массой 0, 1234 г, чтобы на титрование остатка кислоты с метиловым оранжевым израсходовать 19, 50 мл раствора NaOH, T(NaOH/CaO) =0, 002910 г/мл.
- Навеску 0, 1060 г Na2CO3растворили в мерной колбе на 250 мл. Рассчитать титр, молярную концентрацию эквивалента Na2CO3(f(Na2CO3) =1/2)
Вариант 13
- Сколько мл 1М фосфорной кислоты необходимо добавить к 100 мл 0. 1н раствора, чтобы получить 0. 3н раствор? ( f =1/3 )
- К навеске Na2CO3массой 0. 1032г прилили 50. 0 мл 0. 0949 н HCl. Остаток кислоты оттитровали 24. 8 мл 0. 1298 М NaOH по метиловому оранжевому. Вычислить массовую долю (%) индифферентных примесей в образце.
- Вычислить молярную концентрацию тиосульфата натрия, если 20. 0 мл раствора дихромата калия с титром Т (K2Cr2O7/ Fe2+) =0. 005584 г/мл после добавления KJ выделяют такое количество J2, которое оттитровывается 32. 45 мл раствора тиосульфата натрия.
- Сколько грамм KOH, содержащей 4 % индифферентных примесей, следует взять для приготовления 500 мл 1. н раствора ?
Вариант 14
- Сколько мл 10М серной кислоты необходимо добавить к 200 мл 0. 1н раствора, чтобы получить 1 н раствор? ( f =1/2)
- 20 мл раствора, содержащего Fe2+, оттитровали 10 мл 0. 1000 М раствора перманганата калия ( f = 1/5 ) . Какая масса железа содержалась в 100 мл исходного раствора ?
- При определении Cl-иона навеска образца массой 1. г переведена в раствор в мерной колбе на 100мл. К 25 мл этого раствора прибавлено 20 мл 0. 1 М раствора нитрата серебра . Остаток нитрата серебра оттитрован 5. 5 мл 0. 1н раствора роданида калия. Определить % содержание хлорид-иона в образце.
- 4. г NaOH растворили в 100 мл воды. Вычислить массовую долю растворенного компонента, титр, молярную концентрацию раствора.
Вариант №15
... продолжение- Информатика
- Банковское дело
- Оценка бизнеса
- Бухгалтерское дело
- Валеология
- География
- Геология, Геофизика, Геодезия
- Религия
- Общая история
- Журналистика
- Таможенное дело
- История Казахстана
- Финансы
- Законодательство и Право, Криминалистика
- Маркетинг
- Культурология
- Медицина
- Менеджмент
- Нефть, Газ
- Искуство, музыка
- Педагогика
- Психология
- Страхование
- Налоги
- Политология
- Сертификация, стандартизация
- Социология, Демография
- Статистика
- Туризм
- Физика
- Философия
- Химия
- Делопроизводсто
- Экология, Охрана природы, Природопользование
- Экономика
- Литература
- Биология
- Мясо, молочно, вино-водочные продукты
- Земельный кадастр, Недвижимость
- Математика, Геометрия
- Государственное управление
- Архивное дело
- Полиграфия
- Горное дело
- Языковедение, Филология
- Исторические личности
- Автоматизация, Техника
- Экономическая география
- Международные отношения
- ОБЖ (Основы безопасности жизнедеятельности), Защита труда


