Лабораторная работа №3. Качественный анализ органических веществ: обнаружение элементов и функциональных групп


Лабораторная работа №3
КАЧЕСТВЕННЫЙ АНАЛИЗ ВЕЩЕСТВ
Органическими веществами называются такие соединения, в состав которых входит элемент углерод. Кроме углерода, в органических соединения содержится водород, кислород, азот, сера, галогены и другие элементы.
Для обнаружения в составе органического соединения тех или иных элементов требуется разрушение его молекул и перевод составляющих его элементов в простейшие соединения.
Анализ элементного состава может проводится как для качественного определения элементов, входящих в состав органических соединений (С, Н, О и т. д. ), так и для количественного, показывающего процентное содержание в анализируемом органическом соединении С, Н, О, Сl, S, N и т. д. Присутствие тех или иных элементов в органическом соединении может быть обнаружено различными методами анализа.
Качественное определение углерода и водорода основано на сжигании органических веществ. При этом углерод окисляется до двуокиси углерода, а водород - до воды. Образующийся углекислый газ улавливается водным раствором бариевой или кальциевой соли. Вода обнаруживается по появлению капель на холодных стенках пробирки или по изменению окраски (посинению) прокаленного медного купороса.
Для обнаружения азота и серы в органических соединениях, их полностью разрушают прокаливанием в присутствии активных металлов (металлического натрия) . При этом азот частично образует с углеродом и натрием цианистую соль, которую легко обнаружить качественно по образованию комплексного цианида - берлинской лазури. Сера переходит в неорганическую соль - сернистый натрий. Сернистый натрий с нитропруссидом натрия дает малиновое окрашивание, а с азотнокислым свинцом - черный (или темно-коричневый) осадок.
Галогены можно определить качественной пробой Бейльштейна по окраске пламени, что объясняется образованием летучих при высокой температуре галогенидов меди. Эта проба очень чувствительна даже на присутствие следов галогена в органическом соединении. Этот способ был предложен в 1872 году русским академиком Ф. Ф. Бейльштейном и получил название «проба Бейльштейна».
В большинстве случаев органические вещества горят и легко воспламеняются. Некоторое представление о химической природе вещества может дать его поведение при горении. Сильно коптящее пламя горящих паров вещества указывает на высокое содержание в нем углерода.
Для оценки наличия функциональной группы в соединении и его классовой принадлежности используют качественные реакции позволяющие идентифицировать соединении. Функциональная группа включающая гетероатом, определяет свойства целого класса веществ, к которому относится. С помощью качественных реакций можно определить наличие соединения в смеси или выделить вещество из этой смеси. Правильно подобранным реактивом можно различить близкие по свойствам соединения, но относящиеся к разным классам. Например, все спирты взаимодействуют с активными металлами и выделяют водород, но только многоатомные спирты реагируют с гидроксидом меди, образуя соль с характерным окрашиванием раствора, а одноатомные с этим же гидроксидом меди не реагируют.
Определение наличия элемента в соединении
Опыт 1. Горение бензола и спирта.
С 6 Н 6 + 5 О 2 → 3 СО + СО 2 + 3 Н 2 О + 2 С
С 2 Н 5 ОН + 3 О 2 → 2 СО 2 + 3 Н 2 О
Реактивы и материалы: бензол, этиловый спирт.
В две маленькие фарфоровые чашечки помещают: в одну - 2-3 капли бензола, в другую наливают немного этилового спирта. При поджигании бензол горит коптящим пламенем. При внесении в пламя стеклянной пластинки или палочки на них образуется слой копоти. Спирт горит почти бесцветным пламенем.
Опыт 2. Обнаружение углерода и водорода в глицерине.
С 3 Н 8 О 3 + 7 СuO → 3 CO 2 + 4 H 2 O + 7 Cu
CO 2 + Ca(OH) 2 → CaCO 3 + H 2 O
Реактивы и материалы: глицерин, окись меди, баритовая вода (или известковая вода) .
В сухую пробирку помещают 2 мл глицерина и 0, 5-1 г окиси меди (CuO), закрывают ее пробкой с газоотводной трубкой и осторожно нагревают на пламени горелки. Конец газоотводной трубки опускают в пробирку с известковой или баритовой водой (раствор гидроксида кальция или бария в воде) так, чтобы конец газоотоводной трубки был слегка опущен в жидкостью. При нагревании с оксидом меди глицерин разлагается с образованием углекислого газа (СО 2 ) и воды. Выделяющийся углекислый газ взаимодействует с гидроксидом кальция или бария, о чем свидетельствует появление белого осадка малорастворимого углекислого кальция или бария. Образование воды наблюдается по появлению капель на холодных стенках пробирки и трубки.
Опыт 3. Качественное определение азота и серы.
Na + [C] + [N] → NaCN
Na + [S] → Na 2 S
Реактивы и материалы: войлок, натрий (металлический) ; сульфат железа (раствор) ; хлорное железо (раствор), нитропруссид натрия (раствор) ; нитрат свинца; едкий калий (раствор) .
В пробирку помещают исследуемое органическое вещество, содержащее азот и серу (обычно для этой цели используют войлок), и небольшой кусочек металлического натрия. Пробирку прокаливают на открытом пламени горелки до прекращения выделения газообразных веществ . Затем горячую пробирку быстро опускают в фарфоровый стаканчик с 5-6 мл воды так, чтобы пробирка лопнула и содержимое ее перешло в раствор. Образовавшийся раствор отфильтровывают через фильтр и делят на 3 части (в 3 пробирки) .
В полученном растворе должны присутствовать соединения, образующиеся при взаимодействии металлического натрия с азотом и серой.
а) проба на азот
2 NaCN + FeSO 4 → Fe(CN) 2 + Na 2 SO 4
Fe(CN) 2 + 4 NaCN → Na 4 [Fe(CN) 6 ]
3 Na 4 [Fe(CN) 6 ] + FeCl 3 → Fe[Fe(CN) 6 ] 3 + 12 NaCl
Берут 1-2 мл полученной жидкости, добавляют в нее 4-5 капель FeSO 4 и кипятят 1 мин на пламени горелки. Затем раствор охлаждают, подкисляют разбавленной соляной кислотой и прикапывают раствор хлорного железа. Образование синего осадка берлинской лазури указывает, что исходный раствор содержал соединение азота (NaCN) .
б) проба на серу
Na 2 S + Na 2 [Fe(CN) 5 NO] →2 Na 3 [Fe(CN) 5 NOSNa]
К другой части отфильтрованного раствора прибавляют одну каплю раствора нитропруссида натрия. Появление ярко-фиолетового окрашивания указывает на наличие соединений серы в исходном соединении.
в) проба на серу
Pb(NO 3 ) 2 + 4 NaOH → NaNO 3 + 2 H 2 O + Pb(ONa) 2
Na 2 S + Pb(ONa) 2 + 2 H 2 O → PbS + 4 NaOH
Присутствие соединений серы можно также определить, если к исследуемому раствору прибавить несколько капель нитрата свинца в растворе едкого натра. При этом образуется темно-коричневый хлопьевидный осадок (PbS) .
Опыт 4. Определение наличия галогена в соединении .
Реактивы и материалы: четыреххлористый углерод, медная проволока.
Медную проволоку (предварительно хорошо прокаленную) опускают в исследуемое вещество и снова вносят в пламя горелки. В присутствии галогенов пламя окрашивается в зеленый - изумрудный цвет . Это происходит за счет образования при высоких температурах летучих соединений - галогенидов меди.
Определение классовой принадлежности
Опыт 5. Обнаружение многоатомных спиртов (глицерина) .
В пробирку наливают 1 мл раствора сульфата меди (II) и 1 мл раствора гидроксида натрия. К выпавшему осадку гидроксида меди (II) добавляют несколько капель глицерина и взбалтывают содержимое. Осадок растворяется, а раствор приобретает темно-синее окрашивание вследствие образования глицерата меди. Реакция используется как качественная для обнаружения многоатомных спиртов.
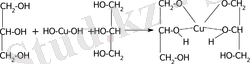
Опыт 6. Цветная реакция на фенол .
Приготовить раствор фенола, поместив на кончике шпателя кристаллический фенол в пробирку с 5 мл воды. Образуется эмульсия, т. к. фенол плохо растворим в холодной воде. Полное растворение происходит при нагреве раствора до 60 0 С. Разделить полученную суспензию на две пробирки. В одну пробирку с раствором добавляют 1 каплю раствора хлорного железа. Наблюдают появление фиолетового окрашивания , вызванного образованием комплексного соединения.
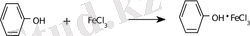
Опыт 7. Обнаружение фенола и его производных .
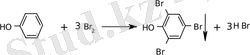
Во вторую пробирку с водной эмульсией фенола добавляют по каплям при постоянном перемешивании бромную воду. Образуется хлопьевидный осадок 2, 4, 6-трибромфенола.
Опыт 8. Обнаружение альдегидов - реакция серебряного зеркала.
... продолжение- Информатика
- Банковское дело
- Оценка бизнеса
- Бухгалтерское дело
- Валеология
- География
- Геология, Геофизика, Геодезия
- Религия
- Общая история
- Журналистика
- Таможенное дело
- История Казахстана
- Финансы
- Законодательство и Право, Криминалистика
- Маркетинг
- Культурология
- Медицина
- Менеджмент
- Нефть, Газ
- Искуство, музыка
- Педагогика
- Психология
- Страхование
- Налоги
- Политология
- Сертификация, стандартизация
- Социология, Демография
- Статистика
- Туризм
- Физика
- Философия
- Химия
- Делопроизводсто
- Экология, Охрана природы, Природопользование
- Экономика
- Литература
- Биология
- Мясо, молочно, вино-водочные продукты
- Земельный кадастр, Недвижимость
- Математика, Геометрия
- Государственное управление
- Архивное дело
- Полиграфия
- Горное дело
- Языковедение, Филология
- Исторические личности
- Автоматизация, Техника
- Экономическая география
- Международные отношения
- ОБЖ (Основы безопасности жизнедеятельности), Защита труда


