Причины и механизмы образования кислотных дождей: источники, химические превращения и экологические последствия


Тип работы: Реферат
Бесплатно: Антиплагиат
Объем: 20 страниц
В избранное:
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ КАЗАХСТАН
Казахский национальный педагогический университет им. Абая
РЕФЕРАТ
НА ТЕМУ:
«Причины и механизм «кислотных дождей»»
Выполнила: студентка
2МТР
Проверила:
Алматы 2007
Содержание.
ВВЕДЕНИЕ. 3
1. Определение темы исследования. 4
2 Поступления в атмосферу соединений азота. 5
2. 1. Виды соединений азота. 5
2. 2 Источники соединений азота. 5
2. 3 Химические превращения соединений серы и азота в атмосфере. 6
2. 3. 1 Химические превращения соединений серы:6
2. 3. 2 Химические превращения соединений азота:8
2. 4 Кислотная седиментация (кислотные дожди) . 8
2. 4. 1 Вымывание кислотных веществ из атмосферы. 8
2. 4. 2 Сухие осадки. 9
2. 5 Влияние кислотных осадков на природу и человека. 9
2. 5. 1 Косвенные воздействия. 10
2. 5. 2 Непосредственные (прямые) воздействия. 12
2. 5. 3 Прямые воздействия на человека. 13
2. 6 Мероприятия по снижению негативного воздействия кислотных дождей. 14
3. Описание взаимосвязей между блоками системы. 16
ЗАКЛЮЧЕНИЕ. 17
Список использованной литературы. 18
Введение.
Человек всегда использовал окружающую среду в основном как источник ресурсов, однако в течение очень длительного времени его деятельность не оказывала заметного влияния на биосферу. Лишь в конце прошлого столетия изменения биосферы под влиянием хозяйственной деятельности обратили на себя внимание ученых. В первой половине нынешнего века эти изменения нарастали и в настоящее время лавиной обрушились на человеческую цивилизацию. Стремясь к улучшению условий своей жизни, человек постоянно наращивает темпы материального производства, не задумываясь о последствиях. При таком подходе большая часть взятых от природы ресурсов возвращается ей в виде отходов, часто ядовитых или непригодных для утилизации. Это создает угрозу и существованию биосферы, и самого человека.
Среди весьма серьезных проблем экологического плана наибольшее беспокойство вызывает нарастающее загрязнение воздушного бассейна Земли примесями, имеющими антропогенную природу. Атмосферный воздух является основной средой деятельности биосферы, в том числе человека. В период промышленной и научно-технической революции увеличился объем эмиссии в атмосферу газов и аэрозолей антропогенного происхождения. По ориентировочным данным ежегодно в атмосферу поступают сотни миллионов тонн оксидов серы, азота, галогенопроизводных и других соединений. Основными источниками атмосферных загрязнений являются энергетические установки, в которых используется минеральное топливо, предприятия черной и цветной металлургии, химической и нефтехимической промышленности, авиационный и автомобильный транспорт.
- Определение темы исследования.
Термином "кислотные дожди" называют все виды метеорологических осадков - дождь, снег, град, туман, дождь со снегом, - рН которых меньше, чем среднее значение рН дождевой воды (средний рН для дождевой воды равняется 5. 6) . Выделяющиеся в процессе человеческой деятельности двуокись серы (SO 2 ) и окислы азота (NО x ) трансформируются в атмосфере земли в кислотообразующие частицы. Эти частицы вступают в реакцию с водой атмосферы, превращая ее в растворы кислот, которые и понижают рН дождевой воды. Впервые термин «кислотный дождь» был введен в 1872 году английским исследователем Ангусом Смитом. Его внимание привлек викторианский смог в Манчестере. И хотя ученые того времени отвергли теорию о существовании кислотных дождей, сегодня уже никто не сомневается, что кислотные дожди являются одной из причин гибели жизни в водоемах, лесов, урожаев, и растительности. Кроме того кислотные дожди разрушают здания и памятники культуры, трубопроводы, приводят в негодность автомобили, понижают плодородие почв и могут приводить к просачиванию токсичных металлов в водоносные слои почвы.
Вода обычного дождя тоже представляет собой слабокислый раствор. Это происходит вследствие того, что природные вещества атмосферы, такие как двуокись углерода (СО 2 ), вступают в реакцию с дождевой водой. При этом образуется слабая угольная кислота (CO 2 + H 2 O -> H 2 CO 3 ) . Тогда как в идеале рН дождевой воды равняется 5. 6-5. 7, в реальной жизни показатель кислотности (рН) дождевой воды в одной местности может отличаться от показателя кислотности дождевой воды в другой местности. Это, прежде всего, зависит от состава газов, содержащихся в атмосфере той или иной местности, таких как оксид серы и оксиды азота.
Кислотный дождь образуется в результате реакции между водой и такими загрязняющими веществами, как оксид серы (SO 2 ) и различными оксидами азота (NO х ) . Эти вещества выбрасываются в атмосферу автомобильным транспортом, в результате деятельности металлургических предприятий и электростанций, а также при сжигании угля и древесины. Вступая в реакцию с водой атмосферы, они превращаются в растворы кислот - серной, сернистой, азотистой и азотной. Затем, вместе со снегом или дождем, они выпадают на землю.
Последствия выпадения кислотных дождей наблюдаются в США, Германии, Чехии, Словакии, Нидерландах, Швейцарии, Австралии, республиках бывшей Югославии и еще во многих странах земного шара.
Кислотный дождь оказывает отрицательное воздействие на водоемы - озера, реки, заливы, пруды - повышая их кислотность до такого уровня, что в них погибает флора и фауна. Водяные растения лучше всего растут в воде со значениями рН между 7 и 9. 2. С увеличением кислотности (показатели рН удаляются влево от точки отсчета 7) водяные растения начинают погибать, лишая других животных водоема пищи. При кислотности рН 6 погибают пресноводные креветки. Когда кислотность повышается до рН 5. 5, погибают донные бактерии, которые разлагают органические вещества и листья, и органический мусор начинает скапливаться на дне. Затем гибнет планктон - крошечное животное, которое составляет основу пищевой цепи водоема и питается веществами, образующимися при разложении бактериями органических веществ. Когда кислотность достигает рН 4. 5, погибает вся рыба, большинство лягушек и насекомых.
Кислотный дождь наносит вред не только водной флоре и фауне. Он также уничтожает растительность на суше. Ученые считают, что хотя до сегодняшнего дня механизм до конца еще не изучен, сложная смесь загрязняющих веществ, включающая кислотные осадки, озон, и тяжелые металлы в совокупности приводят к деградации лесов.
2. Поступления в атмосферу соединений азота.
2. 1 Виды соединений азота.
В состав атмосферы входит ряд азотсодержащих микровеществ, но в кислотной седиментации участвуют только два из них: окись и двуокись азота, которые в результате протекающих в атмосфере реакций образуют азотистую кислоту.
Окись азота под действием окислителей (например, озона) или различных свободных радикалов преобразуется в двуокись азота:

(окись азота + радикал пероксида водорода = двуокись азота + радикал гидроксила) ;

(окись азота + озон = двуокись азота + молекулярный кислород) .
Итак, можно предположить, что окисью азота можно пренебречь вследствие указанных окислительных процессов. Однако это не совсем так, что объясняется двумя причинами. Первая заключается в том, что выброс оксидов азота в значительной степени происходит в форме окиси азота, и требуется время, чтобы
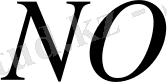 полностью превратилась в
полностью превратилась в
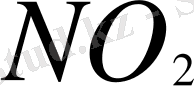 . С другой стороны, в непосредственной близости от источников загрязнения количество окиси азота превышает количество двуокиси азота. Это соотношение увеличивается в сторону двуокиси азота по мере приближения к территориям, непосредственно не подверженным загрязнению. Например, в безусловно чистом воздухе над поверхностью океана часть окиси азота составляет всего несколько процентов от двуокиси азота. Соотношение этих газов, впрочем, может меняться вследствие фотодиссоциации двуокиси азота:
. С другой стороны, в непосредственной близости от источников загрязнения количество окиси азота превышает количество двуокиси азота. Это соотношение увеличивается в сторону двуокиси азота по мере приближения к территориям, непосредственно не подверженным загрязнению. Например, в безусловно чистом воздухе над поверхностью океана часть окиси азота составляет всего несколько процентов от двуокиси азота. Соотношение этих газов, впрочем, может меняться вследствие фотодиссоциации двуокиси азота:
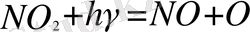
(двуокись азота+ квант света = окись азота+ атом кислорода),
Кислотную среду в атмосфере создает также азотная кислота, образующаяся из оксидов азота. Если находящаяся в воздухе азотная кислота нейтрализуется, то образуется азотнокислая соль, которая обычно присутствует в атмосфере в виде аэрозолей. Это относится также к солям аммония, которые получаются в результате взаимодействий аммиака с какой-либо кислотой.
2. 2 Источники соединений азота.
Эти источники могут быть как естественными, так и антропогенными. Рассмотрим наиболее важные естественные источники.
Почвенная эмиссия оксидов азота. В процессе деятельности живущих в почве денитрифицирующих бактерий из нитратов высвобождаются оксиды азота. Согласно современным данным ежегодно во всем мире образуется 8 млн т оксидов азота.
Грозовые разряды. Во время электрических разрядов в атмосфере из-за очень высокой температуры и перехода в плазменное состояние молекулярные азот и кислород в воздухе соединяются в оксиды азота. В состоянии плазмы атомы и молекулы ионизируются и легко вступают в химическую реакцию. Общее количество образовавшихся таким способом оксидов азота составляет 8 млн т в год.
Горение биомассы. Этот источник может быть как естественным, так и искусственным. Наибольшее количество биомассы сгорает в результате выжигания леса (с целью получения производственных площадей) и пожаров в саванне. При горении биомассы в воздух поступает 12 млн т оксидов азота в год.
Прочие источники
естественных выбросов оксидов азота менее значительны и с трудом поддаются оценке. К ним относятся: окисление аммиака в атмосфере, разложение находящейся в стратосфере закиси азота, вследствие чего происходит обратное попадание образовавшихся оксидов
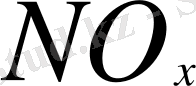 в тропосферу и, наконец, фотолитические и биологические процессы в океанах. Эти естественные источники совместно вырабатывают в год 2-12 млн т оксидов азота.
в тропосферу и, наконец, фотолитические и биологические процессы в океанах. Эти естественные источники совместно вырабатывают в год 2-12 млн т оксидов азота.
Среди антропогенных источников образования оксидов азота на первом месте стоит горение ископаемого топлива (уголь, нефть, газ и т. д. ) . Во время горения в результате возникновения высокой температуры находящиеся в воздухе азот и кислород соединяются. Количество образовавшегося оксида азота NO пропорционально температуре горения. Кроме того, оксиды азота образуются в результате горения имеющихся в топливе азотсодержащих веществ. Сжигая топливо, человек ежегодно выбрасывает в воздух 12 млн т оксидов азота. . Значительным источником оксидов азота также является транспорт.
В целом количества естественных и искусственных выбросов приблизительно одинаковы, однако последние, так же как и выбросы соединений серы, сосредоточены на ограниченных территориях Земли.
Необходимо упомянуть, однако, что количество выбросов оксидов азота из года в год растет в отличие от эмиссии двуокиси серы, поэтому соединения азота играют огромную роль в образовании кислотных осадков.
2. 3 Химические превращения соединений серы и азота в атмосфере.
Попадающие в воздух загрязняющие вещества в значительной мере подвергаются физическим и химическим воздействиям в атмосфере. Эти процессы идут параллельно их распространению. Очень часто загрязняющие вещества, испытав частичное или полное химическое превращение, выпадают в осадок, изменив таким образом свое агрегатное состояние.
Рассмотрим подробнее химические реакции и фазовые изменения, происходящие с атмосферными кислотными микроэлементами (веществами) .
2. 3. 1 Химические превращения соединений серы:
Сера входит в состав в не полностью окисленной форме (степень окисления ее равна 4) . Если соединения серы находятся в воздухе в течение достаточно длительного времени, то под действием содержащихся в воздухе окислителей они превращаются в серную кислоту или сульфаты.
Рассмотрим в первую очередь наиболее значительное с точки зрения кислотных дождей вещество двуокись серы. Реакции двуокиси серы могут протекать как в гомогенной среде, так и в гомогенной.
Одной из гомогенных реакций является взаимодействие молекулы двуокиси серы с фотоном в видимой области спектра, относительно близкой к ультрафиолетовой области:
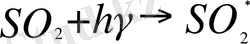 .
.
В результате этого процесса возникают так называемые активированные молекулы, которые располагают избыточной энергией по сравнению с основным состоянием. Звездочка означает активированное состояние. Активированные молекулы двуокиси серы в отличие от «нормальных» молекул могут вступать в химическое взаимодействие с находящимся в воздухе в довольно больших количествах молекулярным кислородом:
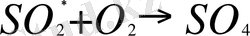
(активированная молекула двуокиси + молекулярный кислород
 свободный радикал)
свободный радикал)

(свободный радикал + молекулярный кислород
 триоксид серы + озон)
триоксид серы + озон)
Образовавшаяся триоксид серы, взаимодействуя с атмосферной водой, очень быстро превращается в серную кислоту, поэтому при обычных атмосферных условиях триокись серы не содержится в воздухе в значительных количествах. В гомогенной среде двуокись серы может вступить во взаимодействие с атомарным кислородом, также с образованием триокиси серы:

(двуокись серы + атомарный кислород
 триокись серы)
триокись серы)
Эта реакция протекает в тех средах, где имеется относительно высокое содержание двуокиси азота, которая также под действием света выделяет атомарный кислород.
В последние годы было установлено, что описанные выше механизмы превращения двуокиси серы в атмосфере не имеют превалирующего значения, так как реакции протекают главным образом при участии свободных радикалов. Свободные радикалы, возникающие при фотохимических процессах, содержат непарный электрон, благодаря чему они обладают повышенной . Одна из таких реакций протекает следующим образом:
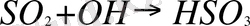
(двуокись серы +радикал гидроксила
 свободный радикал)
свободный радикал)
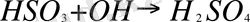
(свободный радикал + радикал гидроксила
 Equation. 3 серная кислота)
Equation. 3 серная кислота)
В результате реакции образуются молекулы серной кислоты, которые в воздухе или на поверхности аэрозольных частиц быстро конденсируются.
Превращение двуокиси серы может осуществляться и в гетерогенной среде. Под гетерогенным превращением мы понимаем химическую реакцию, которая происходит не в газовой фазе, а в каплях или на поверхности частиц, находящихся в атмосфере.
Кроме двуокиси серы в атмосфере можно обнаружить значительное количество других природных соединений серы, которые в конечном счете окисляются до серной кислоты. В их превращении важную роль играют образовавшиеся фотохимическим путем свободные радикалы и атомы. Конечные продукты играют определенную роль в антропогенной кислотной седиментации.
2. 3. 2 Химические превращения соединений азота:
Наиболее распространенным соединением азота, входящим в состав выбросов, является окись азота
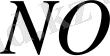 Equation. 3, который при взаимодействии с кислородом воздуха образует двуокись азота. Последний в результате реакции с радикалом гидроксида превращается в азотную кислоту:
Equation. 3, который при взаимодействии с кислородом воздуха образует двуокись азота. Последний в результате реакции с радикалом гидроксида превращается в азотную кислоту:
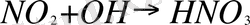
(двуокись азота + радикал гидроксила
 азотная кислота) .
азотная кислота) .
Полученная таким образом азотная кислота может долгое время оставаться в газообразном состоянии, так как она плохо конденсируется. Другими словами, азотная кислота обладает большей летучестью, чем серная. Пары азотной кислоты могут быть поглощены капельками облаков, осадков или частицами аэрозоля.
2. 4 Кислотная седиментация (кислотные дожди) .
Заключительным этапом в круговороте загрязняющих веществ является седиментация, которая может происходить двумя путями. Первый путь вымывание осадков или влажная седиментация. Второй путь выпадение осадков или сухая седиментация. Совокупность этих процессов является кислотной седиментацией.
2. 4. 1 Вымывание кислотных веществ из атмосферы.
Вымывание происходит во время образования облаков и осадков. Одним из условий образования облаков является перенасыщенность. Это означает, что воздух содержит больше водяного пара, чем он может принять при заданной температуре, сохраняя равновесие. При понижении температуры способность воздуха накапливать воду в виде пара уменьшается. Тогда начинается конденсация водяного пара, которая происходит до тех пор, пока не прекратится перенасыщенность. Однако при обычных атмосферных условиях водяной пар способен конденсироваться только при относительной влажности 400-500%. Относительная влажность в атмосфере лишь в редких случаях может превысить 100, 5%. При такой перенасыщенности капельки облаков могут возникать только на частицах аэрозоля так называемых конденсационных ядрах. Этими ядрами часто являются хорошо растворимые в воде соединения серы и азота.
После начала образования капель элементы облака продолжают поглощать аэрозольные частицы и молекулы газа. Поэтому воду облака или его кристаллы можно рассматривать как раствор атмосферных элементов.
Элементы облака не могут безгранично увеличиваться. Возникающая под действием гравитации седиментация, которая растет с увеличением размера капель, рано или поздно приводит к выпадению капель облаков с высоты нескольких сотен или тысяч метров. Во время выпадения эти капли промывают слой атмосферы между облаками и поверхностью земли. В это время поглощаются новые молекулы газа и новые аэрозольные частицы захватываются падающей каплей. Таким образом, достигающая поверхности земли вода вопреки всеобщему мнению никоим образом не является дистиллированной водой. Более того, во многих случаях растворенные в воде осадков вещества могут служить важным и иногда даже единственным источником восстановления запасов этих веществ в различных сферах.
2. 4. 2 Сухие осадки.
Хотя эта форма седиментации существенно отличается от влажной седиментации, конечный результат их действительно идентичен попадание кислотных атмосферных микроэлементов, соединений серы и азота на поверхность Земли. Известно достаточно много разнообразных кислотных микроэлементов, однако содержание большинства из них настолько мало, что их роль в кислотной седиментаци можно не принимать во внимание.
Эти кислотные вещества могут выпадать на поверхность двумя способами. Один из них - турбулентная диффузия, под действием которой в осадок выпадают вещества, находящиеся в газообразном состоянии. Турбулентное диффузионное движение в первую очередь возникает из-за того, что движение струящегося воздуха над почвой и другой поверхностью является неравномерным вследствие трения. Обычно в вертикальном от поверхности направлении ощущается увеличение скорости ветра и горизонтальное движение воздуха вызывает турбулентность. Таким путем компоненты воздуха достигают Земли, и наиболее активные кислотные вещества легко взаимодействуют с поверхностью.
2. 5 Влияние кислотных осадков на природу и человека.
Кислотные осадки оказывают вредное воздействие не только на отдельные предмет или живые существа, но и на их совокупность. В природе и в окружающей среде образовались сообщества растений и животных, между которыми, как и между живыми и неживыми организмами, существует постоянный обмен веществ. Эти сообщества, которые можно также называть экологической системой, обычно состоят из четырех групп: неживые объекты, живые организмы, потребители и разрушители.
Влияние кислотности в первую очередь сказывается на состоянии пресных вод и лесов. Обычно воздействия на сообщества бывают косвенными, т. е. опасность представляют не сами кислотные осадки, а протекающие под их влиянием процессы (например, высвобождение алюминия) . В определенных объектах (почва, вода, ил и т. д. ) в зависимости от кислотности могут возрасти концентрации тяжелых металлов, так как в результате изменения рН изменяется их растворимость. Через питьевую воду и животную пищу, например, через рыбу в организм человека также могут попасть токсичные металлы. Если под действием кислотности изменяются строение почвы, ее биология и химия, то это может привести к гибели растений (например, отдельных деревьев) . Обычно эти косвенные воздействия не являются местными и могут влиять на расстоянии нескольких сотен километров от источника загрязнения.
2. 5. 1 Косвенные воздействия.
... продолжение- Информатика
- Банковское дело
- Оценка бизнеса
- Бухгалтерское дело
- Валеология
- География
- Геология, Геофизика, Геодезия
- Религия
- Общая история
- Журналистика
- Таможенное дело
- История Казахстана
- Финансы
- Законодательство и Право, Криминалистика
- Маркетинг
- Культурология
- Медицина
- Менеджмент
- Нефть, Газ
- Искуство, музыка
- Педагогика
- Психология
- Страхование
- Налоги
- Политология
- Сертификация, стандартизация
- Социология, Демография
- Статистика
- Туризм
- Физика
- Философия
- Химия
- Делопроизводсто
- Экология, Охрана природы, Природопользование
- Экономика
- Литература
- Биология
- Мясо, молочно, вино-водочные продукты
- Земельный кадастр, Недвижимость
- Математика, Геометрия
- Государственное управление
- Архивное дело
- Полиграфия
- Горное дело
- Языковедение, Филология
- Исторические личности
- Автоматизация, Техника
- Экономическая география
- Международные отношения
- ОБЖ (Основы безопасности жизнедеятельности), Защита труда


