Исследование экстракции золота Аламином 336 и алкиланилином в высших карбоновых кислотах из растворов соляной кислоты


Министерство образования и науки Республики Казахстан
Казахский национальный университет им. аль-Фараби
Садирдинова Г. Р.
ЭКСТРАКЦИЯ ЗОЛОТА АЗОТСОДЕРЖАЩИМИ РЕАГЕНТАМИ
ДИПЛОМНАЯ РАБОТА
Специальность 050720 ̶ «Химическая технология
неорганическая веществ»
Алматы, 2012
Министерство образования и науки Республики Казахстан
Казахский национальный университет им. аль-Фараби
«Допущена к защите»
Заведующей кафедрой аналитической и технологии редких элементов
д. х. н., профессор Камысбаев Д. Х.
«»2012 г
ДИПЛОМНАЯ РАБОТА
На тему: «ЭКСТРАКЦИЯ ЗОЛОТА АЗОТСОДЕРЖАЩИМИ РЕАГЕНТАМИ»
по специальности 050720 - «Химическая технология неорганических веществ»
Выполнила Г. Р. Садирдинова
Научный руководитель
к. х. н., доцент Н. Д. Долгова
Нормоконтролер А. М. Аргимбаева
Алматы, 2012
РЕФЕРАТ
Дипломная работа состоит из 49 страниц, 12 рисунков, 10 таблиц, список использованных источников насчитывает 30.
КЛЮЧЕВЫЕ СЛОВА: ЭКСТРАКЦИЯ, ЗОЛОТО, АЛАМИН 336, АЛКИЛАНИЛИН, ВЫСШИЕ КАРБОНОВЫЕ КИСЛОТЫ, СТЕПЕНЬ ИЗВЛЕЧЕНИЯ, АНАЛИЗ
Объекты исследования: модельные растворы золота.
Цель работы: изучение экстракции золота расплавами Аламин 336 и алкиланилином в высших карбоновых кислотах из растворов соляной кислоты.
Использованные приборы и аппаратура: магнитные мешалки, иономер И-160, спектрофотометр Leki SS1207 UV, фотоколориметр КФК-2МП, атомно-абсорбционный спектрометр АА-6200 SHIMADZU, спектрометр «Спектроскан МАКС-GV».
Полученные результаты: подобраны оптимальные условия извлечения золота Аламином 336 и алкиланилином в высших карбоновых кислотах из солянокислых растворов. Предложен состав экстрагируемого комплекса золота Аламином 336. Построен градуировочный график определения золота в экстрактах.
Реферат
Бітіру жұмыс 49 беттен, 12 суреттен, 10 кестеден және 30 әдебиет тізімінен турады.
КІЛТ СӨЗДЕР: ЭКСТРАКЦИЯ, АЛТЫН, АЛАМИН 336, АЛКИЛАНИЛИН, ЖОҒАРЫ КАРБОН ҚЫШҚЫЛДАРЫ, ТАРАЛУ КОЭФИЦИЕНТІ, АНАЛИЗ.
Зерттеу объектілері: алтындың модельды ерітінділері.
Жұмыстың мақсаты: тұз қышқылды ортадан алтынның ЖҚҚ-да Аламин 336 және алкиланилинмен экстракциялық заңдылығын зерттеу.
Қолданылған құрылымдар: магнитті араластырғыштар, Leki SS1207 UV спектрофотометрі, КФК-2МП фотоколориметрі, АА-6200 SHIMADZU атом-абсорбциондық спектрометрі, «Спектроскан МАКС-GV» рентгено-флуоресценттік спектрометрі.
Алынған нәтижелері: тұз қышқылынан алтынды ЖҚҚ-да Аламин 336 және алкиланилинмен бөліп алу үшін оптималды жағдайлар таңдап алынды. Аламин 336-мен экстракциялянған алтын комплексінің құрамы анықталды. Экстраттағы алтынның рентгенофлуоресцентті анықталу графигі тұрғызылды.
Введение
Золото веками продолжает оставаться одним из наиболее востребованных благородных металлов. В последние десятилетия объем потребления золота постепенно смещается в сторону азиатских стран. В связи с ростом благосостояния населения этих стран, потребительский спрос на золото в них будет оставаться довольно высоким
Выделяют три основных сегмента потребления золота: ювелирная промышленность, инвестиционный спрос и потребление в промышленных целях. С учетом цены на золото и потребительских настроений, соотношение трех сегментов потребления золота меняется весьма значительно.
Недавние исследования открыли новые горизонты применения золота: например, в качестве катализатора в топливной системе автомобилей, в химической промышленности и в сфере контроля над загрязнением окружающей среды. Все большее количество золота применяют в медицине, как в лечебных, так и в косметических целях.
В системе мирохозяйственных связей золото было и остается одним из самых конкурентоспособных товаров, а его коммерческая разработка - залог успешного продвижения страны в число 50-ти наиболее конкурентоспособных стран мира.
Для определения микроколичеств благородных металлов в основном используются физические и физико-химические методы анализа. Однако определение микрокомпонентов с их использованием с достаточной точностью не всегда возможно в виду сложности анализируемых объектов и низких концентраций ионов металлов. Ограниченная чувствительность и селективность инструментальных методов предполагает проведение концентрирования элементов перед их определением. Поэтому усовершенствование методик концентрирования благородных металлов, в том числе и золота, а также разработка и физико-химическое обоснование новых методик представляет интерес, как для развития новых комбинированных методов анализа, так и для технологии переработки бедного золотосодержащего сырья.
Основными преимуществами экстракционного метода являются высокая избирательность и чистота разделения, возможность работы как с большими, так и с самыми малыми концентрациями, отсутствие загрязнений продуктов, легкость технологического и аппаратурного оформления, возможность осуществления непрерывного процесса, автоматизации, а также высокая производительность.
Целью данной работы является изучение экстракции золота расплавами Аламина 336 и алкиланилина в высших карбоновых кислотах из растворов соляной кислоты.
- ЛИТЕРАТУРНЫЙ ОБЗОРОбщая характеристика золота и его свойства
Золото - элемент первой группы периодической системы элементов Д. И. Менделеева; его порядковый номер 79, атомная масса 196, 967 [1] .
Золото - блестящий тяжелый металл желтого цвета, физические константы его приведены в таблице 1.
Таблица 1- Физические константы золота
Плотность при 18° С, г/см 3
при 1063° С, расплавленное
при 1063° С, твердое
19, 31
17, 3
18, 2
Удельная электропроводность, обр·ом/см 2 , при 25° С
при 18 0 С
41, 6-10 4
41, 3-10 4
Температурный коэффициент электросопротивления
(25-100° С)
Золото принадлежит к самым благородным металлам. На него не действуют разбавленные и концентрированные кислоты: НС1, HNO 3 , H 2 SО 4 . Золото растворяется в смеси (3 : 1) НС1 + HNО 3 .
В большинстве своих соединений золото проявляет степени окисления +1, +2, +3. Из соединений наиболее часто встречаются такие, в которых золото проявляет степень окисления +1 и +3.
Для золота характерна способность к комплексообразованию с кислородсодержащими лигандами, аммиаком и аминами, серусодержащими лигандами; известны внутрикомллексные соединения.
В химически чистом виде золото встречается редко. Самородное золото содержит 4-15% Ag. Содержание других элементов в разновидностях золота представлены в таблице 2.
Таблица 2- Содержание других элементов в разновидностях золота
Содержание золота в минералах других элементов колеблется в широких пределах. Наиболее известные минералы золота приведены в таблице 3.
Таблица 3- Химический состав основных минералов золота
Наиболее крупные коренные месторождения золота обнаружены в Южной Африке, где золото встречается в виде тонких прожилок в кварцитах. Изучение модельных систем показало, что если концентрация кислорода определяется равновесием
3Fe 2 O 3 ↔︎ 2Fe 3 O 4 + 0, 5 О 2
А концентрация хлорид-ионов и рН задаются буферной системой слюда - полевой шпат - кварц, то при высоких давлениях и температурах 400 - 600 0 С, а такие условия вполне возможны, растворение золота происходит по реакции типа
2Au + 1, 5 O 2 + 12HCl ↔︎ 2H 3 AuCl 6 + 3H 2 O
При охлаждении раствора до 300 - 400 0 С концентрация кислорода и HCl, по-видимому, резко снижается и золото повторно осаждается из раствора. Тип образующегося осадка, очевидно зависит от конкретных условий и характера конвекционных течений охлаждающихся растворов или путей движения этих растворов под гидростатическим давлением через пустоты породы. В некоторых случаях возможен гидротермальный перенос золота в виде комплексного иона [Au(SH) 2 ] - [3] .
Основными источниками производства золота в мире являются коренные руды и россыпи. Руды разделяют на окисленные, смешанные и сульфидные, и, соответственно, разработаны технологические приемы извлечения золота. Окисленные руды эффективно перерабатывают методами. Смешанные и сульфидные - с использованием обогатительных приемов. Продукты металлургической переработки соответствуют по содержанию благородных металлов требованиям аффинажного производства. Что касается гравитационных и флотационных концентратов, то, как по содержанию золота и серебра, так и сопутствующих примесей, они не удовлетворяют этим требованиям. Как правило, данные продукты подвергают металлургической доводке до соответствующей кондиции [2] .
Красота и редкость золота обусловили применение его во всем мире для изготовления ювелирных изделий и для чеканки монет, а также в качестве основы денежных систем [3] .
В чистом виде золото применяют в небольших количествах в медицине, для покрытий и изготовления контактов. Температуру плавления золота принимают за постоянную точку при градуировании термометров. Сплавы золота используют для изготовления электрических контактов, обмоток сопротивления потенциометров, фильер для стекловолокна. В ювелирной промышленности применяют двойные и тройные сплавы с Си, Ag, с добавками Pt, Pd, Zn, Sn и других элементов. Для зубоврачебной практики готовят сплавы Au-Сu-Ag-Pt и Au-Ag-Cd-Zn [1] .
1. 2 Состояние минерально-сырьевой базы и добычи золота на месторождениях Казахстана
По разведанным запасам золота Казахстан занимает 9 место в мире (3-е в СНГ), а по добыче - 13, 4 т - 25-е место (4-е в СНГ) [4] .
Государственным балансом Республики Казахстан учтены запасы по 237 объектам, из которых 122 коренных, 81 комплексных и 34 россыпных. Месторождения золота выявлены во всех регионах Казахстана, по уровню запасов лидирующее положение занимают Восточный, Северный и Центральный Казахстан. По производству золота в Казахстане превалирует Восточно-Казахстанская область (таблица 4) .
Золоторудные и золотосодержащие месторождения локализованы в 16 горнорудных районах, важнейшими из которых являются: Калбинский и Рудно-Алтайский в Восточном Казахстане (месторождения Бакырчик, Большевик, Риддер-Сокольное и др. ) ; Кокшетауский и Жолымбет-Бестобинский в Северном Казахстане (месторождения Васильковское, Жобымбет, Бестобе и др. ) ; Шу-Илийский и Джунгарский в Южном Казахстане (Акбакай, Бескемпир, Архарлы и др. ) ; Майкалинский и Северо-Балхашский в Центральном Казахстане (Майкаин, Бощекуль, Саяк IV, Долинное и др. ) ; Жетыгаринский и Мугоджарский в Западном Казахстане (Жетыгара, Комаровское, Юбилейное и др. ) .
Таблица 4 - Производство золота по регионам
В сравнении с золоторудной минерально-сырьевой базой мира, в Казахстане более существенную роль, как в запасах, так и в добыче играют комплексные месторождения, гораздо меньший удельный вес имеют золото-меднопорфировые месторождения. По уровню запасов, их качеству основные золоторудные месторождения Казахстана сопоставимы с месторождениями зарубежных стран и в принципе могли бы обеспечить более высокий уровень производства золота в стране. Вместе с тем, при неблагоприятной мировой конъюнктуре золота, неизбежным становится предъявление более жестких требований к качественным и количественным параметрам отдельных месторождений и к минерально-сырьевой базе в целом.
Основными проблемами минерально-сырьевой базы золоторудной промышленности Казахстана являются следующие:
- Отсутствие крупных резервных собственно золоторудных месторождений, которые могли бы служить базовыми объектами для устойчивого развития отрасли на длительную перспективу.
- Более 50% имеющихся активных запасов руд характеризуются как сложные для обогащения, содержат вредные примеси - мышьяк и сурьму.
При благоприятной конъюнктуре и льготном налогообложении некоторое дополнительное количество золота может быть получено из многочисленных мелких месторождений Казахстана.
Основными геолого-промышленными типами месторождений золота в Казахстане являются: кварцево-жильный, штокверковый, минерализованных зон, комплексный (медный, колчеданно-полиметаллический) . На долю экзогенных месторождений (россыпи и золотоносные коры выветривания) приходится около 2% активных запасов.
Жильный тип объединяет разнообразные по геологическим условиям формирования месторождения. Магматический фактор является ведущим, контролирующим в размещении таких типов месторождений. Месторождения тесно ассоциируют с малыми интрузиями порфировой формации диорит-гранодиоритового ряда (Бестобе, Акбакай и др. ) . По морфологии выделяются жильные зоны, жильные поля и штокверки. Они представлены рудами, отличаются широким спектром минеральных видов и являются основными объектами добычи. Руды легкообогатимые.
Штокверковый тип характеризуется прожилково-вкрапленным оруденением, связанным с системами разноориентированных кварцевых, кварц-сульфидных и кварц-карбонатных прожилков, приуроченных к эндо- и экзоконтактовым частям интрузий.
В таблице 5 приведены данные по среднему содержанию золота в рудах в различных месторождениях Казахстана [5] .
Таблица 5- Средние содержания золота в рудах в различных месторождениях Казахстана
Из рисунка 1 следует, что в период с 2004 по 2008 года объемы производства необработанного золота почти в два раза превышает аффинированное золото.
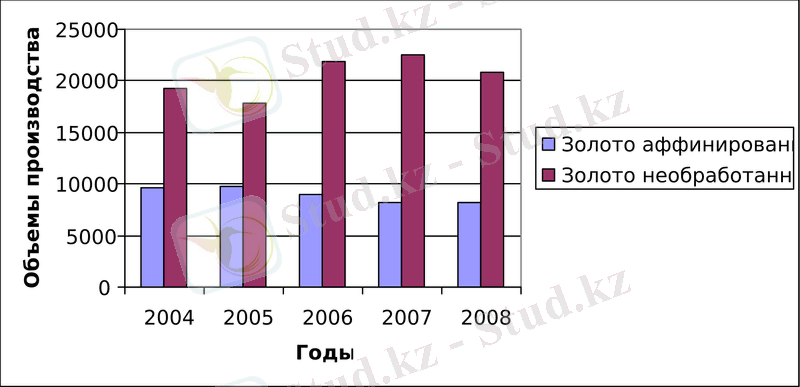
Рисунок 1- Добыча и переработка золота в Казахстане
Причины, по которым предприятия, добывающие золото, отправляют получаемые концентраты на аффинаж за рубеж:
- Меньшая плата по НДПИ;
- Проблема реализации - ограниченный объем закупок со стороны Нацбанка;
- Длительные сроки заключения контрактов на выполнение работ по аффинажу (иностранные фирмы работают в режиме электронных торгов) .
- Большое время на выполнение заказа на переработку;
- Проблемы, возникающие с объемами готовой продукции - разногласия между заказчиком и переработчиком.
К малым и даже средним месторождениям золота Казахстана зарубежные инвесторы пока интереса не проявляют. Освоение этих объектов возможно лишь при привлечении местного капитала, так как разработка малых месторождений имеет определенные экономические преимущества (прежде всего, выгодное географическое положение и высокое содержание золота в руде) [4] .
1. 3 Экстракционное концентрирование золота
Одним из перспективных методов разделения и концентрирования является экстракция [6] .
Экстракция - метод, основанный на распределении растворённого вещества между двумя жидкими несмешивающимися фазами. Обычно в практике применяют системы, в которых одной фазой является водный раствор, а второй - органический растворитель. Экстракцию принято считать относительно молодым методом. Наиболее мощный толчок развитие
экстракции получило только в середине прошлого столетия в связи с работами в области ядерной технологии. Работы в области экстракции микроэлементов проводились, конечно, и ранее.
Начало количественному описанию экстракции (с химических позиций) положили Кольтгоф и Сендел, которые вывели в 1941 году уравнение, характеризующее экстракцию хелатов. Ирвинг и Уильямс развили эту теорию. Последующие интенсивные исследования привели к выяснению химизма большинства экстракционных процессов [7] .
Современные экстракционные методы достаточно универсальны. Трудно найти типы соединений, которые нельзя было бы экстрагировать. С помощью экстракции можно разделять многокомпонентные системы, причем эффективнее и быстрее, чем это достигается другими методами. Экстракционные методы пригодны для абсолютного и относительного концентрирования, извлечения в экстракт микроэлементов или матрицы, индивидуального и группового выделения элементов. Выполнение экстракционного разделения и концентрирования обычно не требует сложного и дорогостоящего оборудования. В лаборатории это чаще всего делительная воронка. С помощью воронки проводят периодическую экстракцию. Водный раствор пробы и органический растворитель тщательно перемешивают встряхиванием вручную или с помощью механического устройства. После разделения фаз нижнюю фазу сливают через кран. Сильное встряхивание нежелательно, так как оно может привести к образованию стойких эмульсий, что затрудняет разделение двух фаз. Если извлечение нужного компонента неполное, экстракцию повторяют, разделив фазы и прибавив к водной фазе новую порцию органического растворителя.
Экстракция - сложный физико-химический процесс. Теория экстракции
находится на стыке различных разделов химии: химической термодинамики,
... продолжение- Информатика
- Банковское дело
- Оценка бизнеса
- Бухгалтерское дело
- Валеология
- География
- Геология, Геофизика, Геодезия
- Религия
- Общая история
- Журналистика
- Таможенное дело
- История Казахстана
- Финансы
- Законодательство и Право, Криминалистика
- Маркетинг
- Культурология
- Медицина
- Менеджмент
- Нефть, Газ
- Искуство, музыка
- Педагогика
- Психология
- Страхование
- Налоги
- Политология
- Сертификация, стандартизация
- Социология, Демография
- Статистика
- Туризм
- Физика
- Философия
- Химия
- Делопроизводсто
- Экология, Охрана природы, Природопользование
- Экономика
- Литература
- Биология
- Мясо, молочно, вино-водочные продукты
- Земельный кадастр, Недвижимость
- Математика, Геометрия
- Государственное управление
- Архивное дело
- Полиграфия
- Горное дело
- Языковедение, Филология
- Исторические личности
- Автоматизация, Техника
- Экономическая география
- Международные отношения
- ОБЖ (Основы безопасности жизнедеятельности), Защита труда


