Химиялық байланыстың негізгі түрлері: ковалентті полюсті және полюссіз байланыстар


Ақтөбе облысы
Қобда ауданы
Құрсай негізгі мектебі
Химия және биология пәнінің мұғалімі:Имангазина А. М
Сабақтың тақырыбы: Химиялық байланыстың негізгі түрлері. Ковалентті полюсті және полюссіз байланыстар.
Сабақтың мақсаты:
- Білімділік:І-ІІІ период элементтерінің атомдарындағы электрондардың орналасуы туралы білімін бекіту. Атом құрылысының белгілі заңдылықтары негізінде химиялық ковалентті байланыстардың түзілу мәнін таныстыру,
- Дамытушылық:ковалентті байланысқан жай заттардың электрондық формуласын құру білігін қалыптастыру.
- Тәрбиелік:Ғылыми көзқарасты қалыптастыру.
Сабақтың түрі: Жаңа сабақ.
Пәнаралық байланыс: физика
Құрал-жабдықтар: Д. И. Менделеевтің периодтық жүйесі, интерактивті тақта. «Химиялық байланыстардың түрлері», «Химиялық байланыстың түзілуі кестесі атом құрылысының үлгілері».
Сабақтың барысы.
Ұйымдастыру:
Оқушылармен сәлемдесу, оларды тізім бойынша түгендеу.
Сабаққа дайындықтарын тексеру.
Үй тапсырмасын сұрау:
Оқушылардың білімі мен білігін тексеру . Сыныптағы бірнеше оқушыға жазбаша сұрақтар беріледі (карточка түрлері) .
ЭЛЕМЕНТТЕРДІҢ САЛЫСТЫРМАЛЫ ЭЛЕКТРТЕРІСТІЛІГІ
2, 1
-
0, 97
1, 47
2, 01
2, 50
3, 07
3, 5
4, 10
-
1, 01
1, 23
1, 47
1, 74
2, 1
2, 6
2, 83
-
0, 91
1, 04
1, 20
1, 32
1, 45
1, 56
1, 60
1, 64
1, 70
1, 75
1, 75
1, 66
1, 82
2, 02
2, 20
2, 48
2, 74
-
0, 89
0, 99
1, 11
1, 22
1, 23
1, 30
1, 36
1, 42
1, 45
1, 35
1, 42
1, 46
1, 49
1, 72
1, 82
2, 01
2, 21
-
0, 86
0, 97
1, 08
1, 23
1, 33
1, 40
1, 46
1, 52
1, 55
1, 44
1, 42
1, 44
1, 44
1, 55
1, 67
1, 76
1, 90
-
0, 86
0, 97
1, 00
**Актиноидтар - 1, 11 - 1, 20
1. Электртерістілік дегеніміз не?-
Атомдардың өзіне электрондар тарту қабілетін электртерістілік деп атайды.
- *Электртерістілік*пен*Электртерістік*ұғымдарының айырмасы неде?
*Электртерістік*-кез келген элемент атомының өзіне электрон тарту және өзінен электронды тебу қабілетін.
- Мына элементтерді периодтық кесте көмегімен немесе кесте көмегімен электртерістіктерінің өсу ретімен орналастырыңдар.
Mg, P, S, Si, O, Al- Жауабы: Mg, Al, Si, , P, S, O,
- Натрий мен фтор атомының құрылыс сызбанұсқасын сызып көрсет. Олардың химиялық автивтілгін қалай түсіндірсең?
- Период және негізгі топша бойынша элементтердің қасиеттері қалай өзгереді?
- Период бойынша солдан оңға қарай электртерістік артады, ал негізгі топшада төменнен жоғары қарай артады.
- Осы өзгерістердің себебі неде?
- Осыған орай периодтық жүйеден кез келген екі элементтің қайсысының электртерістілігі күшті екенін айтуға болады.
III. Жаңа сабақ:
Жаңа материалды оқыту. Химиялық байланыс дегеніміз не???
-Атомдар әрекеттескен кезде олардың арасында химиялық байланыс түзіледі.
- Химиялық байланыс дегеніміз молекулаларда және кристалдық торларда атомдар арасындағы электрлік тартылыс күштерінің әсерінен атомдардың өзара тартылып байланысуы.
-Химиялық байланыс неліктен түзіледі???
-Химиялық байланыс түзілгенде сыртқы қабаттағы электрондар өзгеріске ұшырайды. Олардың саны көбейеді немесе азаяды. беріп жіберу немесе қосып алу қасиеттерін электртерістігі сиапттайды. .
Химиялық байланыстың типтері:
1-Коваленттік-полюсті және полюссіз
2-Иондық
3-Металдық
- Екі атом арасында химиялық байланыс электрон жұбы ортақтасуы арқылы түзілсе, олковалентті байланысдеп аталады.
- Электртерістіктері бірдей атомдар арасындаковаленттік полюссізхимиялық байланыс түзіледі.

ЭЛЕМЕНТТЕРДІҢ САЛЫСТЫРМАЛЫ ЭЛЕКТРТЕРІСТІЛІГІ
Мысалы:молекулалар өзара бірдей екі атомнан тұратын жай заттар. - Н 2 , СІ 2 , О 2 , N 2
Одан әрі электрондық формула құрудың алгоритімімен таныстыру.
- Сәйкес келетін атомдардың химиялық таңбасын тізіп жазу.
- Элементтің периодтық жүйедегі орнын (қай топқа) табу.
- Берілген элементтің орналасқан тобына сәйкес валенттік электрондардың санын белгілеу.
- Нүктелер арқылы элемент атомдарындағы дара электрондардың жалпы санын белгілеп, электрондық қабатын аяқталуына неше электрон жетпейтінін анықтау.
- Әр атомның химиялық таңбасының айналасына нүктелеріне қалған электрондарды белгілеу.
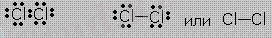
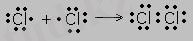
Н 2 , СІ 2 , О 2 , N 2 элементтерінің электрондық формуласын жазып болған соң, осы формуладағы нүктелермен көрсетілген элетрон жұптарын сызықшамен ауыстырса құрылымдық формула алынатынын түсіндіру. Тақтаға және дәптерге төмендегіше жазылады:
Электрондық формула: Құрылымдық формула:
Н:Н :СІ:СІ: :О:О: :N:N: Н:СІ: Н-Н, СІ-СІ, О=О, N-N, Н-СІ
Ковалентті полюсті байланысты малекуланың құрылымдық формуласында электрон тығыздығының бір атомынан өткінші атомға ығысуын бағдаршамен көрсетеді. Электрон тығыздығын өзіне тартатын электрон элемент атомы ішінара теріс зарядталады. Ал өзінен ығыстыратын элемент атомы ішінара оң зарядталады. Мысалы: Н + →СІ -
Атом құрылысы заттардың құрылыс теориясымен, дәлірек айтқанда химиялық байланыс теориясымен тығыз байланысты. Теорияны оқыту, әдеттегідей коваленттік байланыстан басталады.
Қарама-қарсы спиндері бар жұптаспаған екі s- электрондарының қосылуын кванттық ұяшықтарда сызбанұсқамен былай белгілейді:
S 1 + S 1 → 1S 2
- Жалпы алғанда, әрекеттесуші атомдардың электртерістіктерінің айырмашылықтарына байланысты, көбіне полюстібайланыс арқылы түзіледі.
Коваленттік полюсті байланыстарда бүркесу зонасы электртерістігі үлкен атомға ығысқан. Мысал ретінде газтектес хлорсутектің түзілуін қарастырайық:
Байланыс s- және p- электрондардың ортақ жұптарының түзілу есебінен пайда болады. Коваленттік байланыс электрондық орбитальдардың бүркесу тәсілі бойынша да ерекшеленеді. Коваленттік байланыстың екі маңызды сипаттамасы бар: байланыс ұзындығы және байланыс энергиясы. Байланыс ұзындығы ядроаралық қашықтықтың шамасына сәйкес келеді. Байланыс ұзындығы неғұрылым аз болса, химиялық байланыс соғұрылым берік болады. Байланыс энергиясы молекуладағы бар байланысты үзуге қажет энергияға тең.
Коваленттік байланыс түзілуінің донорлы-акцепторлы механизмдері бар. Донор- бұл бос электрондық бұлты бар атом, ал акцептор- бұл электрон жұбын қабылдауға қабілетті бос орбиталы бар бөлшек.
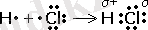
- Полюсті молекуладағы электрондар ығысқан кезде атомдар қосымша зарядқа ие бола бастайды. Молекуланың бір жағы оң, бір жағы теріс зарядталады. Мұндай молекулалар полюсті деп аталады. Коваленттік полюсті байланыс көбіне қышқылдар арасында болады. Мысалы HF, H2S, HNO3, H2SO4, т. с. с
Ковалентті байланыстың екі түрлі үлгісін ұсынамыз.
Химиялық байланыстың түзілуі.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz