Фосфордың қосылыстары: фосфин, фосфор оксидтері және фосфор қышқылдары мен тұздары


Сабақтың тақырыбы: Фосфордың қосылыстары.
Сабақтың мақсаты: Білімділік:Оқушыларға фосфордың маңызды қосылыстары- фосфин, фосфор(v ) оксиді, ортофосфор қышқылы және тұздары туралы мағлұмат беру.
Дамытушылық:Оқушылардың химиялық білімін одан әрі дамыту, тез ойлауға, шапшаңдыққа, өз бетімен ізденуге үйрету. Ой-өрісін, шығармашылық мүмкіндігін, ғылымы көзқарасын қалыптастыру.
Тәрбиелік:Өздігінен талпынып, жауапкершілікті сезінетін саналы, өнегәлі ұрпақ тәрбиелеу.
Сабақтың түрі:Аралас сабақ
Сабақтың әдісі:Оқу мен жазу арқылы сын тұрғысынан ойлауды дамыту технологиясының элементтері.
Қөрнекілігі: Периодтық жүйе, электронды оқулық, реактивтер, кестелер.
Сабақ барысы: І. Ұйымдастыру кезеңі.
ІІ. Үй тапсырмасын сұрау:
І,, Даналық ағашы ,, іскерлік ойының сұрақтары:
№1. 1. Фосфор: Химиялық таңбасы . Р
. Реттік нөмірі. 15
Валенттігі. ІІІ, V
Тотығу дәрежесі. +3, +5
Атом құрылысының электрондық формуласы:1s 2 2s 2 2p 6 3s 2 3p 3
№2. 2. Химиялық диктант: 1. фосфордың аллотропиялық түр өзгерістері___, ___, ___. 2. фосфорэлементі 3. өте улы, , ___ улы емес
4. ___ + ___ = 2 Р 2 О 5 . ___ + ___ = Cа 3 Р 2
___ + ___ = РСІ 5 . ___ + ___ = РН 3
Жауаптары:1. ақ, қара, қызыл
2. Ақыл-ой элементі
3. ақ фосфор, қызыл, қара
4. Р + О 2 =2Р 2 О 5. 3Са +2Р= Са 3 Р 2. 2 Р+5СІ 2 =2РСІ 5 . 2Р +3Н 2 = 2РН 3
№3. Сандарды сөйлетейік ойыны.
Жауаптары. 1. 1669ж. неміс алхимигі Х. Бранд фосфорды ашты. 2. Ет ұлпасында 56г. фосфор кездеседі. 3. Адам сүйегінде 600г фосфор бар. 4. Жүйке жүйесінде 5г фосфор болады.
№4. Қолданылуы. Фосфор сіріңке жасау үшін
Дәрі- дәрмектер алуда
тыңайтқыштар
ІІІ. Жаңа сабақты түсіндіру.
Сабақтың тақырыбы: Фосфордың қосылыстары
1. Фосфин-РН 3 2. Фосфор (ІІІ) оксиді-Р 2 О 3 4. Фосфор қышқылы Н 3 РО 4 3Фосфор(V) оксиді-Р 2 О 5 5. Мета фосфор қышқылы НРО 3
Физикалық қасиеттері. Н 3 РО 4
РН 3 Р 2 О 3 Р 2 О 5
Фосфин- өте улы, тұрақсыз, түссіз, сарымсақ иісті, күшті тотықсыздандырғышзат. Фосфор(v) оксиді -өте ылғал тартқыш зат, ақ түсті ұнтақ зат. Фосфор (ІІІ) оксидібалауыз тәрізді кристалдық масса, улы. Фосфор қышқылы- ақ түсті кристалдық зат, суда жақсы ериді.
Са 3 Р 2 +6Н 2 О = 2РН 3 +3Са(ОН) 2 Алынуы Р 2 О 5 +3Н 2 О=2Н 3 РО 4
4Р +3О 2 =2Р 2 О 3 Р 2 О 5 +Н 2 О=2НРО 3 (тәжірибе)
4Р +5О 2 = Р 2 О 5
Химиялық қасиеттері :Фосфин ауада фосфор оксидін түзіп, өздігінен тұтанады:2РН 3 +5О 2 = 2Р 2 О 5 +3Н 2 О . Фосфин суда аммиактан нашар ериді және сілтілк қасиет көрсетпейді . Бірақ аммиак сияқты өте күшті қыщқылдармен әрекеттесіп, тұз түзеді. Бұл кезде аммоний ионына пайда болады: РН 3 +НІ=РН 4 І
Фосфор(V) оксиді-өте ылғал тартқыш болғандықтан, реакция теңдеуін былай жазуға да болады.
РН 3 +2О 2 =Н 3 РО 4 .
Р 2 О 5 -суда ерігенде температураға байланысты әртүрлі фосфор қышқылындарын түзеді:
Р 2 О 5 +Н 2 О=2НРО 3 метафосфор қышқылы . Р 2 О 5 +3 Н 2 О= 2 Н 3 РО 4. ортофосфор қышқылы Фосфор (V) оксиді қышқылдық оксид болғандықтан сілтілермен әрекеттеседі: 6NаОН+ Р 2 О 5 =2 Na 3 PO 4 +3H 2 O .
Негіздік оксидпен әрекеттеседі: СаО+ Р 2 О 5 = Са 3 (РО 4 ) 2 + 3Н 2 О
Фосфор қышқылы суда ерігенде сатылап диссоциацияланады:
Н 3 РО 4 Н + +Н 2 РО 4 - дигидрофосфат ион
Н 2 РО - 4 ⇆ Н + +НРО 4 2- гидрофасфат ион
НРО 2- 4 ⇆ Н + +РО 4 3- фосфат ион
Фосфор қышқылы сілтімен сатылап әрекеттеседі: Н 3 РО 4 +3NaOH = Na 3 PO 4 +3H 2 O.
Н 3 РО 4 +NaOH = NaH 2 PO 4 + H 2 O. Н 3 РО 4 +2NaOH = Na 2 HPO 4 +2 H 2 O
Табиғи фосфаттар суда ерімейді. Оларды фосфор қышқылымен өңдеп, ерімтал тұздарға айналдырады да, минералдық тыңайтқыш ретінде пайдаланады. Мысалы:
Са 3 (РО 4 ) 2 +4 Н 3 РО 4 =3Са( Н 2 РО 4 ) 2 кальций дигидрофосфаты.
Фосфат ионға РО 4 3- сапалық реакция: Н 3 РО 4 +3AgNO 3 =Ag 3 PO 4 +3HNO 3
РО 4 3- +3Ag + =Ag 3 PO 4
ҚОЛДАНЫЛУЫ
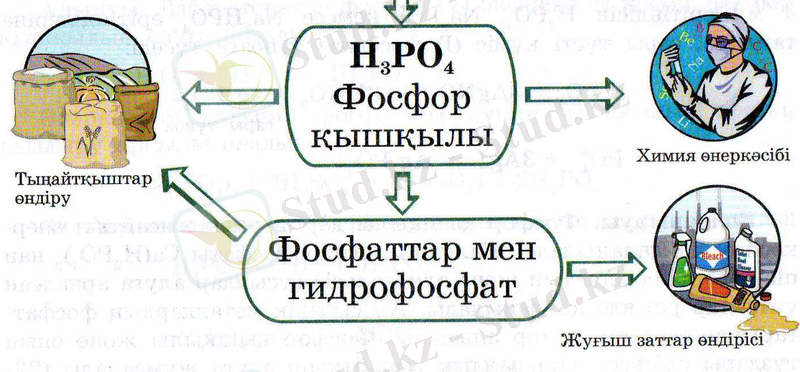
Фосфор қышқылының тұздары.
Дигидрофосфаттар NaH 2 PO 4
Фосфаттар Na 3 PO 4 Гидрофосфаттар Na 2 HPO 4
Фосфор қышұылының орта тұздары фосфаттар. Егер сутек иондары металл атомдарымен толық алмаспаса, қышқыл тұздар түзіледі. Олар гидрофосфаттар, дигидрофосфаттар деп аталады.
ІV. Жаңа сабақты бекіту :1 Сәйкестілік тест
1. РН 3 а) Фосфор қышқылы
2. Н 3 РО 4 ә) фосфин
3. НРО 3 б) метафосфор қышқылы
4. К 3 РО 4 в) калий гидрофосфаты
5. К 2 НРО 4 г) калий фосфаты
2. Оқулықпен жұмыс:6-жаттығу
V. Үйге тапсырма 19. 7-жаттығу
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz