Атомдық құрылысы және атомдардағы электрондардың қозғалысы


VІ тарау. Д. И. Менделеев жасаған химиялық элементтердің периодтық жүйесі және периодтық заңы. Атом құрылысы.
Сабақ тақырыбы: Атомдардағы электрондардың қозғалысы
Сабақтың мақсаты:
Білімділік: Атом құрылысы тұрғысынан периодтық заңның мәнін одан әрі аша түсу, негізгі топшадағы химиялық элементтердің атом құрылысы мен оның қасиеттерінің өзгеру заңдылығын түсіндіру.
Дамытушылық: Период, топ бойынша элемент атомындағы электронның орналасу тәртібі мен заңдылығын және элемент қасиетінің өзгеру себебін түсіндіру, білімдерін дамыта түсу.
Тәрбиелік:
Сабақ әдісі : баяндау, сұрақ - жауап
Сабақ жоспары: 1. Ұйымдастыру
2. Өткен тақырыпқа пысықтау сұрақтары
3. Жаңа тақырып
4. Үй тапсырмасы
5. Үй тапсырмасын сұрау
6. Бағалау
Өткен тақырыптарға пысықтау сұрақтары:
- Изотоптар дегеніміз не?
- Химиялық элемент дегеніміз не?
- Фтор атомындағы электрондардың энергетикалық деңгейлерге орналасыун көрсет. (протон, нейтрон санын анықта)
Сабақтың барысы:
Атом моделінің электрон бұлтының құрылысы
Электрон бұлты болатын кеңістікті
орбиталь
деп атаймыз.
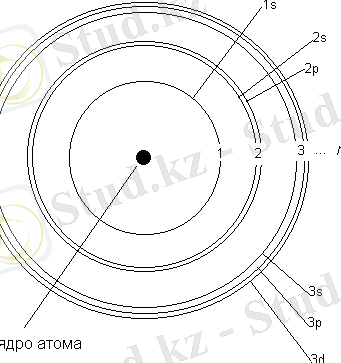
Электрондық қауыз:
- Атомның барлық электрондары жиналыпэлектрондық қауызынқұрайды.
- Өзара энергиясы жуық электрондар атомның электрондық қабатын түзеді.
- Электрондық қабаттар рет нөміріне қарай 1, 2, 3, 4… деп белгіленеді.
- Әр қабаттағы орбитальдардың өзіндік энергиясы мен пішіндері болады.
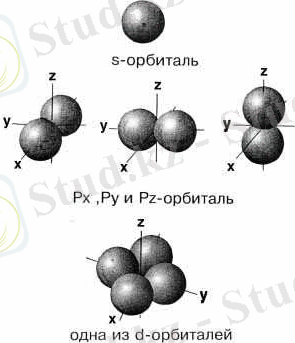
- Шар тәрізді электрон бұлтын s-электрондар деп, ал орбитальдарды s-орбиталь д. а.
Кейбір электрондар ядро маңында гантель тәрізді бұлт түзіп қозғалады, ондай электрондар p - орбитальдарын береді. Кеңістікте координаттардың 3 осі (x, y, z) бойынша орналасатындықтан рx, рy, рz орбитальдары деп бөлінеді
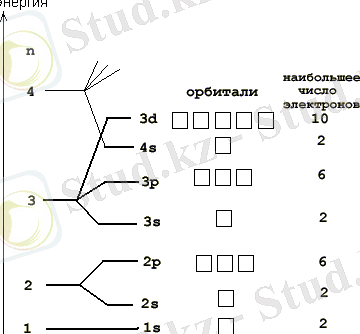
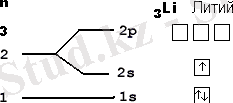
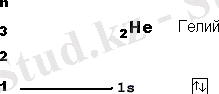
Көптеген атомдардағы бірінші электрондық деңгейінің орбитальды диаграммасы жоғарыда көрсетілген.
Электрондық бұлттарды толтыру ережесі келесі:
- 1. Ең алдымен элемент атомында қанша электрон бар екендігін анықтап алу. Ол үшін сол элементтің ядро зарядын білсек болғаны, ол Д. И. Менделеевтің периодтық жүйедегі элементтің реттік нөміріне тең. Реттік нөмірі (ядродағы протон саны) барлық атомдағы электрон санына тең.
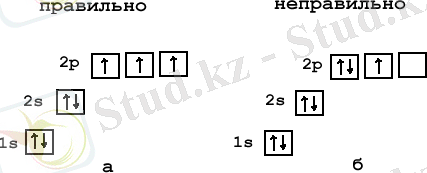
- 2. Бар электронмен 1s - орбитальдан бастап ұяшықтарды толтырамыз. Әрбір ұяшықта 1 не 2 электрон бола алады. Бір ұяшықта орналасқан екі электронды қарама - қарсы бағдаршамен белгілілейді .
- 3. Элементтің электрондық формуласын жазамыз.
Сфералы
(шар тәрізді)
Сегіздік
(гантель)
Ұяшықтарды толтыру тізбегі:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
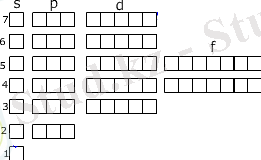
Қайсы электрондық конфигурация дұрыс толтылрылған?
Жаңа тақырыпты бекіту:
жаттығулар беріледі.
Үйге тапсырма: § 57 Атомдардағы электрондардың қозғалысы.
Есептер жинағы: 104-105 бет 5-56, 5-57, 5-67, 5-68 жаттығуларды орындау
Бағалау:

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz