Фосфор: периодтық жүйедегі орны, атом құрылысы, табиғаттағы кездесуі, қасиеттері және қолданылуы


Тақырыбы: Фосфор
Мақсаты: Білімділік - Оқушыларға фосфордың периодтық жүйеде орналасуы, атом құрылысы, табиғатта кездесуі және маңызды өнеркәсіптік кендері жөнінде жан - жақты білім беру.
Тәрбиелік - Оқушыларда фосфордың физикалық және химиялық қасиеттері және қолданылуы жөнінде білімді қалыптастыра отырып, оларды адамгершілікке, ұйымшылдыққа, өз ойын еркін жеткізе білуге тәрбиелеу.
Дамытушылық - Оқыту кезінде оқушылардың танымдық қызығушылығын, шығармашылық қабілеттерін, жігерін, көңіл - күйін, тілі, жадысы, ынтасы, қиялы мен қабылдауы сияқты танымдық қабілеттерін дамыту.
Көрнекілігі: Д. И. Менделеев жасаған химиялық элементтердің периодтық жүйесі, интерактивті тақта, эпиграф, сіріңке, электрондық оқулық.
Сабақтың түрі: аралас сабақ
Сабақтың барысы:
- Ұйымдастыру.
- Үй тапсырмасын тексеру.
- Жаңа сабақ меңгерту.
- Сабақты қорытып бекіту.
- Үйге тапсырма беру.
- Бағалау.
- Қорытынды.
Сабақтың барысы:
I. Ұйымдастыру.
Оқушылармен амандасып, сабаққа даярлығын, оқушылардың сабаққа қатысымын тексеріп, жаңа сабаққа даярлау.
II. Үй тапсырмасын тексеру.
Азот және оның қосылыстары тақырыбы бойынша төмендегі тапсырмаларды орындау. (Оқушыларға тапсырмалар жазылған парақтар таратылады. )
№ 1 тапсырма.
ГРАФИКАЛЫҚ ТЕСТ.
1. Азот II периодтың Y тобының негізгі топшасында орналасқан.
2. Азоттың ең сыртқы энергетикалық деңгейшесінде 7 электрон бар.
3. Бос күйіндегі азот ауаның 78, 1 % - ін құрайды.
4. Азот сутекпен әрекеттесіп, аммиак түзеді.
5. Аммиак қышқылдармен әрекеттесіп, аммоний тұздарын түзеді.
6. Азот қышқылының тұздары сульфаттар деп аталады.
7. Азот ( IY ) оксиді негіздік оксид.
8. Азот қышқылы түссіз, өзіне тән иісі бар газ.
9. Азот қосылыстарда -3, +5, +3 тотығу дәрежелерін көрсетеді.
10. Нитраттар көбінесе азот тыңайтқыштары ретінде қолданылады.
№ 2 тапсырма.
ТОЛЫҚТЫРУ ТЕСТІ.
- Таза азот , иіссіз .
- өткір иісті тұншықтырғыш газ.
- Азот ( IY) оксиді өткір иісті тұншықтырғыш, түсті, газ.
- Азот қышқылы түссіз, өзіне тән иісі бар .
- Азот ( II) оксиді түссіз, өте аз еритін .
Керекті сөздер: газ, улы, аммиак, газ, сұйықтық, суда, қоңыр, түссіз.
№ 3 тапсырма.
СӘЙКЕСТЕНДІРУ ТЕСТІ.
- Аммиак - а) HNO3
- Азот ( IY) оксиді - ә) NH4CL
- Азот қышқылы - б) NaNO3
- Аммоний гидроксиді - в) NH3
- Натрий нитраты - г) NH4OH
- Аммоний хлориді - д) NO2
III. Жаңа сабақ меңгерту.
Химиялық элементтердің периодтық жүйесінде фосфор III периодта, Y топтың негізгі топшасында орналасқан. Салыстырмалы атомдық массасы 31, реттік нөмірі ( ядро заряды) 15.
Атом құрылысы. Фосфордың соңғы энергетикалық қабатында бес электрон бар, оның үшеуі жұптаспаған. Фосфор атомындағы электрондардың орналасуы:
+15 Р ) 2e - ) 8e - ) 5e -
Электрондық формуласы: 1s 2 2s 2 2 p 6 3s 2 3p 3
Фосфор қосылыстарында -3, +3, +5 тотығу дәрежесін көрсетеді.
Фосфордың ұшқыш сутекті қосылыстары фосфин мен аммиак молекулалары формасы жағынан ұқсас болғанмен, фосфин молекуласы берік емес, улы, тұрақсыз газ, тез тотығып кетеді.
Фосфорды 1669 жылы неміс алхимигі Х. Бранд ашқан.
Табиғатта кездесуі. Табиғатта фосфор тау жыныстары мен минералдарда қосылыс түрінде кездеседі. Мысалы, фосфорит және апатитте кальций фосфаты түрінде болады. Қазақстанда Жамбыл облысындағы Қаратау маңында фосфорит кенінің мол қоры бар екені 1935 жылдан бері белгілі. Қазір Қаратау бассейні негізінде « Жаңатас байыту комбинаты» жұмыс істейді. Ақтөбе облысында фосфорит кен орнын ( Шилісай, т. б) игеру жоспарланып отыр. Осы кен кен орындары негізіде фосфорды өңдейтін зауыттар Таразда, Шымкентте және Ақтөбеде бар.
Азот тәрізді фосфор да өсімдік пен жануар нәруызының негізгі құрам бөлігі. Фосфор өсімдіктердің дәнінде, жануарлардың сүтінде, қанда, ми мен жүйке ұлпаларында кездеседі. Мысалы, ересек адамдардың сүйегінде 600 г, ет ұлпасында 56 г, жүйке жүйсінде 5 г - ға дейін фосфор болады.
Барлық сүтқоректілердің сүйегі құрамында фосфор фосфат түрінде болады. Осындай фосфаттар сүтқоректілер қаңқасына беріктік қасиет береді. Жануарлар мен адамдар фосфорды өсімдік арқылы қабылдайды. Фосфор қосылыстары тіршіліктегі барлық зат алмасу процестеріне қатысады.
Алынуы. Бос күйіндегі фосфорды алу үшін табиғи фосфаттарды электр пеште кремний (IY) оксиді мен көмірді қосып қыздырады. Бөлінген фосфордың буын су астында ақ фосфор Р 4 түрінде бөліп алады. Реакция теңдеуі:
2Ca 3 (PO 4 ) 2 + 6SiO 2 + 10 C = P 4 + 6 CaSiO 3 + 10CO ↑
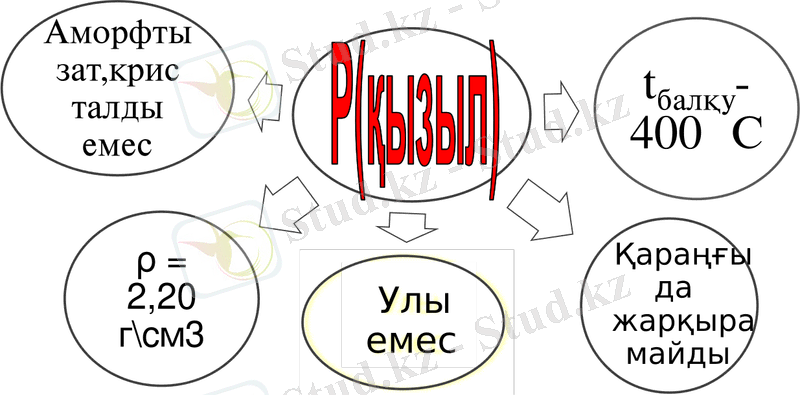
Физикалық қасиеттері. Фосфор элементі жай зат ретінде бірнеше аллотропиялық түрөзгерісін түзеді. Оның маңыздылары - ақ және қызыл фосфор. Ақ фосфор улы және оның тез тұтанатын болғандықтан аса ұқыптылықты қажет етеді. Оның буымен дмалуға болмайды. Ақ фосфорды шыны ыдыста су астында сыртынан құм салынған металл банкаға орналастырып сақтайды. Ақ фосфор ауасыз кеңістікте қыздырғанда қызыл фосфорға, ал жоғары қысымда қара фосфорға айналады. Қара фосфор аз кездеседі.

Химиялық қасиеттері. Фосфор тотықтырғыш және тотықсыздандырғыш қасиет көрсетеді. Тотықсыздандырғыш ретінде оттекпен және белсенді бейметалдармен реакцияға түседі.
- Фосфор оттекте жанып, пентаоксид түзеді:
4Р + 5О 2 = 2P 2 O 5
- Фосфор металдармен фосфидтер түзе әрекеттеседі:
3Са + 2 Р = Ca 3 P 2
3Zn + 2 P = Zn 3 P 2
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz