10-сыныпқа арналған азот оксидтері мен азот қышқылының сабақ жоспары


Облыстық жаратылыстану-математика пәні мұғалімдері олимпиадасы
10 сынып
Алмағанбетова Тиллектес
Бейнеу ауданы
«Абай атындағы орта мектебі»ММ
химия пәні мұғалімі
№28 мектеп. Ақтау. 2011.
Т. Алмағанбетова
Маңғыстау облысы, Бейнеу ауданы
«Абай атындағы орта мектебі»ММ
Сабақтың тақырыбы: Азот оксидтері, азот қышқылы.
Сабақтың білімділік мақсаты: Азот оксидтері мен азот қышқылының алыну тәсілдері және қасиеттерімен таныстыру.
Сабақтың тәрбиелік мақсаты: Оқушыларды ұқыптылыққа, қоршаған ортаны таза ұстауға тәрбиелеу.
Сабақтың дамытушылық мақсаты: қосылыстарды және теңдеулерді дұрыс жазуын дамыту.
Сабақтың көрнекілігі: периодтық кесте, үлестірмелі қағаздар, слайдтар, ойын элементтері.
Сабақтың түрі: аралас сабақ
Сабақтың әдісі: сұрақ-жауап, есептер шығару, жұмбақ шешу.
Сабақтың пәнаралық байланысы: биология, әдебиет.
Сабақтың барысы: 1. Ұйымдастыру.
2. Үй тапсырмасын сұрау.
Ι. «Мектеп-білім ордасы» бекеті
- Азоттың периодтық жүйедегі орнына сипаттама беру.
- Азоттың ауадағы көлемдік үлесі қанша пайызды құрайды?
- Азоттың сутекті қосылысы не деп аталады?
- Лабораторияда аммикты қалай аламыз?
- Аммоний ионының сапалық реакциясы
- Аммиак молекуласы құрамындағы азоттың массалық үлесін табыңдар.
- Айналымды жүзеге асыру:NH4Cl→NH3→NH4NO3NH_{4}Cl\ \rightarrow {NH}_{3} \rightarrow {NH}_{4}{NO}_{3}
3. Жаңа сабақты түсіндіру
ΙΙ Білім алу бекеті
Азот мынадай оксидтер түзеді: Азот(Ι) оксиді N 2 O, азот (II) оксиді NO, азот(III) оксиді N 2 O 3 , азот (IV) оксиді NO 2 (N 2 O 4 ), азот (V) оксиді N 2 O 5 , бұларда азот +1 ден +5ке дейінгі барлық тотығу дәрежелерін көрсетеді. Практикалық жағынан маңыздылары азот (ΙΙ) және азот(ΙV) оксидтері.
NO - қышқылдық та, негіздік те қасиеттер көрсетпейтін, түссіз газ. Ол -151, 8 0 C - та сығылады, - 163, 7 0 С-та қатады. Суда нашар ериді: 0 0 С-та 1 көлем суда 0, 07 көлем NO ериді.
2NO + O 2 = 2NO 2 + 123 кДж
Алынуы: N 2 + O 2 = 2NO; 3Cu + 8HNO 3 = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
NO 2 - өзіне тән иісі бар қоңыр түсті газ. Буы улы, онымен тыныс алғанда адам уланады. 21, 3 0 С-та сұйылады, 9, 3 0 С-та түссіз кристалдық массаға айналады. Азот (ΙV) оксидінің NO 2 молекуласында жұптаспаған электронның болуына байланысты, ол димерленіп, N 2 O 4 -ті түзуге бейім келеді.
Азот қышқылының физикалық қасиеттері: - өткір иісті, түссіз, сұйықтық (тығыздығы 1, 52г/мл), - 42 0 С-та кристалдық күйге ауысады. Өте ылғал тартқыш. Ауада ол «түтіндейді», өйткені оның буы ауаның ылғалымен тұманның ұсақ тамшыларын түзеді. Сумен кез келген арақатынаста араласады, 86 0 С-та қайнайды.
Химиялық қасиеттері:
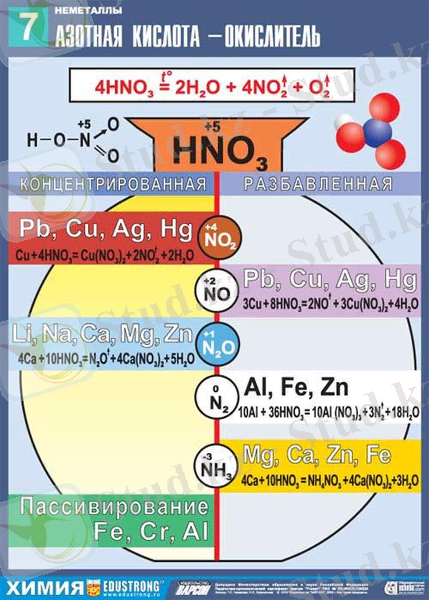
Азот қышқылы Pt, Rh, Pd, Ir, Au-мен әрекеттеспейді. Бір көлем азот және үш көлем концентрлі хлорсутек қышқылынан тұратын қоспаны «патша арағы» деп атайды. Ол күщті тотықтырғыш болып табылады және металдарды тотықтырады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz