Химия сабағы: Натрий - қасиеттері, алынуы және қолданылуы


Атырау облысы, Индер ауданы, Б. Нысанбаев атындағы орта мектептің химия-биология пәні мұғалімі Оспанова Г. А
Сабақтың тақырыбы: Натрий, қасиеттері, алынуы, қолданылуы.
Сабақтың мақсаты:
Білімділік: Оқушыларға натрий, қасиеттері, алынуы, қолданылуы,
қосылыстары туралы жалпы түсініктер беріп, күшті
тотықсыздандырғыштар, қасиеттерін ажырата білу, алыну
жолы, маңызын түсіндіру, мағлұматтар беру
Дамытушылық: Оқушылардың химиялық білімін одан әрі дамыту, тез
ойлауға, шапшаңдыққа, өз бетімен ізденуге үйрету, ой-
өрісін, шығармашылық мүмкіндігін, ғылыми көз-қарасын
қалыптастыру.
Тәрбиелік: Натрийдің өнеркәсіпте күнделікті тұрмыста қолданылуы,
алған білім дағдыларын өмірде пайдалану, өздігінен
талпынып, жауапкершілікті сезінетін, өнегелі ұрпақ
тәрбиелеу.
Сабақтың түрі: Дәстүрлі сабақ
Сабақтың типі: Аралас сабақ
Сабақтың әдісі: Сұрақ -жауап, практикалық тәжірибе, ойындар, есептер т. б.
Көрнекілігі: Интерактивті тақта, үлестірмелі қағаздар, тәжірибеге
қажетті құрал жабдықтар, жаттығу есептері.
Сабақтың барысы: І. Ұйымдастыру кезеңі
ІІ. Үй тапсырмасын тексеру: Қызығушылықты ояту үшін сұрақ -жауап интерактивті тақтадан Д. И. Менделеевтің периодтық таблицасы көрсетіліп сұрақтар койылады.
- Сілтілік металдар қай топта орналасқан?
- Сілтілік металдарды ата?
- Қандай топшада орналасқан?
- Валенттілігі нешеге тең?
- Электртерістілігі қандай?
- Тотығу дәрежесі қанша?
- Ядро заряды +11 ге тең қай элемент?
III. Жаңа сабақты түсіндіру:
Оқушылар тақырыпты дәптерлеріне жазады. Қызығуды ояту.
№1 Тәжірибе:
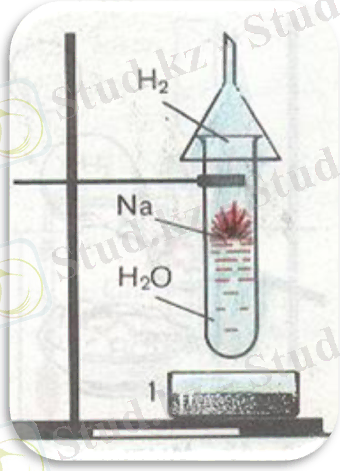
Натрийдің сумен әрекеттесуі. Метал натрийді пышақпен кесіп алып, суға салып жібереміз, сол кезде натрий судың бетінде жүгіре жөнеледі. Осы тәжірибені қызықтаған оқушылар мына жұмбақты шешеді.
Ақ түйір айналады, тыным таппай,
Жүргендей су бетінде орын жоқтай.
Сәлден соң суға сүңгіп жоқ болады,
Не түзілді қай элемент кім айтады? (Натрий гидрооксиді)
Тақтада сұрақ-жауап түрінде сызбанұсқа құралады.
1. Тірек сызба
Алынуы: 1807жылы ағылшын ғалымы Сэр Х. Дэви электролиз арқылы металл күйіндегі натрийді алды. Металл күйдегі натрий гидрооксидінің балқымасын электролиздеу арқылы бөліп алды. Қосылыстардың балқымасын электр тогымен ыдыратып алады
электр тогымен
2NaCl 2Na + Сl 2
2. Тірек сызба. Атом құрылысы.
+11 Na 2e) 8e) 1e)
Электрондық формуласы : 1s² 2s² 2p6 3s¹
Графиктік формуласы:
1s² 2s² 2p 6 3s¹
3. Тірек сызба. Физикалық қасиеттері:
Жұмсақ Иілімді
Созылады Оңай кесіледі
Судан жеңіл Na Электр тогын өткізеді
0, 97г/см³ тығыздығы Жылуды өткізеді
Күйдіргіш Балқуы 4767ºС
Оқушыларға натриймен жұмыс істегенде қауіпсіздік техникасының ережелерін сақтау қажет екенін түсіндіремін.
4. Тірек сызба.
Химиялық қасиеттері:
F 2
О 2 СL 2
жанады
Na
H 2 O S
“жүгіре” бастайды тұтанады
- 4Naº+O2º →2Na2+¹O-²
- 2Na+S→Na2S
- 2Na+2H2O→2NaOH+H2
Натрий иондары жалынды сары түске бояйды, ол үшін платина сымын алақанға салып ұстап, содан соң спирт шамының жалынына ұстаса жалын сары түске боялады. Неге? (себебі, адам терлегенде алақанда ас тұзы болады. )
Сілтілік MeO күшті негіздік қасиет көрсететін ақ түсті зат.
Na 2 O +2H 2 O =2NaOH
Олар теріні, матаны,
қағазды жеп жібереді.

5. Тірек сызба. Табиғатта кездесуі.
Ашылу тарихы.
Натрий “натрон”, “сода”, “сілті”, деген араб сөздерінен шыққан. Натрийдің көмір қышқыл тұзы өте ерте кезден-ақ кір жууға пайдаланған. Сол кезде оның гидрат тотығыда белгілі болған оны сілті деп атаған.
6. Тірек сызба. Қолданылуы :
Авиациямен мен ядролық Органикалық химияда өршіткі.
реакциялардың жылу
тасымалдағышы.
Металлургияда Na Лампаларды натрий
тотықсыздандырғыш. буымен толтырады.
Көлікте натрийдің
қорғасынмен құймасынан Медицинада радиоактивті
подшипниктер изотоптар
дайындалады.
Алғаш натрийді күшті тотықсыздандырғыш ретінде алюминий өндіруге пайдаланды. Сол кезде алюминий алтыннанда қымбат болды. Қазір натрийді таза алтын алуға қолданады.
7. Тірек сызба. Натрий қосылыстары.
Na
8. Тірек сызба.
жасанды талшық сода тұрмыста
бояу NaOH қолданылуы қағаз
дәрі-дәрмек сабын
NaCl - ас тұзы тамаққа қосылады, ол консервілеуші зат, бактерияларды жояды.
Na тамаққа
Сода NaCl қолданылуы
бактерияларды жояды
NaOH Cl
Na 2 SO 4 * 10 Н 2 О глаубер тұзы шыны
Na 2 SO 4
қолданылуы
сода
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz