9-сынып химиясы: Кальцийдің атом құрылысы, физико-химиялық қасиеттері және қолданылуы


Берілгені:
V m = 22, 4 л/моль
m (Me) = 8г
V(Н 2 ) = 4, 48л
т/к: М (Ме) - ?
Шешуі:
Ме + 2Н 2 О → Ме(ОН) 2 + Н 2 ↑
8г Ме 4, 48 л Н 2
х Ме 22, 4 л/моль Н 2
х= 40 г/моль
Жауабы: М(Са) =40 г/моль
«Химия» оқулығы, Н. Нұрахметов, К. Сарманова, К. Жексембина. 9 сынып оқулығы,
Алматы «Мектеп» 2013 жыл. Есептер мен жаттығулар жинағы - 9 сыныпқа арналған
Кальций атомының құрылысы, қасиеттерін, күнделікті өмірде қолдану білетін болады
Химиялық реакция теңдеулерін жазу қабілеті қалыптасады.
Интерактивті тақта, Химиялық элементтердің периодтық кестесі,
Химия 9 сынып, «PPt » тест
Мұғалімнің іс-әрекеті
Ұйымдастыру кезеңі
-Оқушыларды түгелдеу
-Оқушыларды s. p . d. элементтері жазылған парақшалар арқылы
3 топқа бөлу
Сабақтың барысы: Өткен сабақты қайталау
«Химиялық ой жинау»
- Металдарға жалпы сипаттама; ПЖО.
- Жалпы физикалық қасиеттері.
- Жалпы химиялық қасиеттері.
- Ме активтік қатарын кім ұсынған?
- Ме табиғатта қандай түрінде кездеседі?
«Кім көп біледі ?» Миға шабуыл
- Металдар периодтық жүйеде қалай орналасқан?
А. Сол жағы төменгі бөлігінде Ә. Оң жағы жоғары бөлігінде
Б. Оң жағы төменгі бөлігінде
- Металдар арасындағы химиялық байланыс пен кристалл торы А. Металдық байланыс металдық кр. торы
Ә. Металдық байланыс иондық кр. торы
Б. Иондық байланыс металдық кр. торы
- Металдар қандай қасиет көрсетеді
А. Тотықтырғыш Ә. Тотықсыздандырғыш
Б. Екеуінде
- Қосымша топшада тек . . . орналасқан
А. Металдар Ә. Бейметалдар Б. Металдар, бейметалдар
- Металдардың сыртқы энергетикалық деңгейінде . . . - ке дейін электрон ғана болады
А. 4 - 8 Ә. 1-8 Б. 1-3
- Электрохимиялық кернеу қатарында тотықсыздандырғыштық қасиеті
А. Кемиді Ә. Артады Б. Артады, сосын кемиді
- Металдардың активтік қатарын жасаған ғалым
А. Бекетов Н. Н. Ә. Ломоносов М. В. Б. Менделеев Д. И.
- Металдардың активтің қатары қай жылы ашылды
А. 1785 Ә. 1682 Б. 1865 ж
- Сумен әрекеттеспейтін металдар
А. Алтын, күміс, сынап Ә. Калий, нарий, литий
Б. Алюминий, мырыш, темір
- Табиғатта қосылыс түрінде де, бос күйінде де кездеседі
А. Калий, нарий, литий Ә. Алтын, күміс, сынап
Б. Алюминий, мырыш, темір
- Қыздырғанда тотығады
А. Алтын, күміс, сынап Ә. Калий, нарий, литий
Б. Алюминий, мырыш, темір
- Сумен қыздырғанда әрекеттеседі
А. Калий, нарий, литий Ә. Алтын, күміс, сынап
Б. Алюминий, мырыш, темір
«Мен кіммін ?»
1- топ. Тотығу дәрежесі +2 - ге тең, 8 гр металл сумен реакцияласқанда 4, 48л сутегі (қ. ж. ) бөлінді. Металдың
молярлық салмағын анықтап, оны атаңыз.
Шығарылуы:
2-топ. Массасы 5 г сілтілік жер металы ауадағы оттекпен тотықтырылған. Алынған оксид сумен әрекеттескенде массасы 9, 25 г металл гидроксиді түзілген. Қандай сілтілік жер металы алынған?
Шешуі: Химиялық реакция теңдеулері:
2Ме + О 2 = 2МеО
МеО + Н 2 О = Ме(ОН) 2
m(ОН - ) = 9, 25г - 5г = 4, 25г
4, 25г (ОН - ) - - - 5гМе
34г/моль (ОН - ) - - - М (Ме) г/моль
М(Ме) = 40 г/моль
3-топ. 4г екі валентті металл броммен әрекеттескенде оның 20г бромиді алынған. Бұл қандай металл екенін анықтаңдар.
Шешуі: Химиялық реакция теңдеуі:
4г хг 20г
Ме + Br 2 = МеBr 2
4г+х=20г
х= 20г-4г
х= 16г Br 2
v(Br 2 ) = m(Br 2 ) / M (Br 2 ) = 16г/160г/моль = 0, 1 моль
М(Ме) = m(Ме) / М(Ме) = 4г/ 0, 1моль = 40 г/моль Са (кальций)
Негізгі бөлім
Тақтаға жаңа сабақтың тақырыбы жазылады.
Сабақтың мақсатын анықтау
Мәтінмен танысып шығады.
І-тапсырма: Мәтін топтарға бөлініп беріледі.
І-топ: Кальцийдің химиялық элементтердің периодтық
жүйесіндегі орны, алынуы
ІІ-топ: Кальцийдің физикалық, химиялық қасиеттері
ІІІ-топ: Кальцийдің табиғатта таралуы, қолданылыуы
ІІ-тапсырма:
Эксперименнттік бөлім. Оқушыларға тапсырма беріледі
I топ тапсырмасы:
8 сыныптағы «Д. И. Менделеевтің заңы мен жүйесі» тақырыбынан алған теориялық білімдеріңізге сүйеніп, кальций элементіне сипаттама беріңіздер. (Периодтық жүйе пайдаланылады)
II топ тапсырмасы:
Кальцийдің химиялық қасиеттерін сипаттайтын мына рекция теңдеулерін аяқтаңыздар.
- Са+Cl2
- Са+S
- Са+Н2
- Ca+O2
- Ca+HCl
- Ca+H2O
III топ тапсырмасы:
Берілген айналымдарды іске асыруға болатын химиялық реакция теңдеулерін жазып көрсетіңдер:
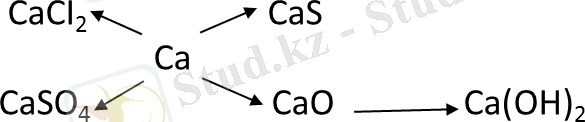
Осы тапсырмалар бойынша әр топ өздерінің білімін ортаға салды, ары қарай мұғалім толықтырды.
Қорытынды бөлім
« Асулардан асайық » есептер шығару
1-топқа. 20% қоспасы бар 7г техникалық кальцийді 100г суда ерітті. Алынған ерітіндідігі кальций гидроксидінің массалық үлесін табу
2-топқа.
Теориялықпен салыстырғанда шығымы 90%болса, 106 кг әктас ыдырағанда кальций оксидінің қанша массасы алынады?
3-топқа. Массасы 250 г кальций корбанатын тұз қышқылымен әрекеттескенде (қ. ж. ) қанша көлем көмір қышқыл газы түзілді?
Бекіту
Сабақ рефлексиясы
Үйге тапсырма беру: § 32
1. Кальций тақырыбын оқу, тірек хабарларды пайдалана отырып, реакция теңдеулерін жазу
2. Есептер мен жаттығулар жинағы
№ 9-2, № 9-7 жаттығу (84бет)
Бағалау. Сабаққа қатысқан оқушылардың белсенділігін бағалау.
Берілгені:
m(Са) = 7 г
w(қоспа) = 20%
m(Н 2 О) = 100 г
т/к:
w (Са(ОН) 2 - ?
Шешуі:
w(т. з) = 100% - 20% = 80%
m(т. з)
w(т. з) = * 100%
m ( жалпы )
w(т. з) * m ( жалпы 80% * 7 г
m(т. з) = = = 5, 6 г
100% 100%
m(ерт) = 5, 6 г + 100 г = 105, 6 г
2-әдіс:
Ca + 2Н 2 О → Ca(OН) 2 + Н 2 ↑
M(Ca) = 40 г/моль
М (2Н 2 О) = 36 г/моль
М(Ca(OН) 2 ) = 74 г/моль
5, 6г Ca х г Ca(OН) 2
40 г/мольCa 74 г/моль Ca(OН) 2 х= 10, 36г
100г Н 2 О - - - - х г Ca(OН) 2
36 г/моль Н 2 О - - 74 г/моль Ca(OН) 2
х= 205, 6г
w (Са(ОН) 2 = 10, 36г * 100% / 205, 6г = 5%
Берілгені:
ή(тео. ) = 90%
m (CaCO 3 ) = 10кг
т/к:
m (СаО) - ?
Шешуі:
t
CaCO 3 → CaO + CO 2 ↑
M(CaCO 3 ) = 40+16*3=100 г/моль
M(CaO) = 40+16= 56 г/моль
10кг CaCO 3 х г СаО
100 г/мольCaCO 3 56 г/моль СаО
х= 5, 6 кг
5, 6 кг СаО 100%
х кг СаО 90%
х = 5, 04 кг. СаО
Жауабы: m (СаО) = 5, 04к г
Берілгені:
V m = 22, 4 л/моль
m (CaCO 3 ) = 250г
т/к: V (СаО) - ?
Шешуі:
t
CaCO 3 + 2НСІ → CaСІ 2 + CO 2 ↑ + Н 2 О
M(CaCO 3 ) = 40+16*3=100 г/моль
250г CaCO 3 х л СаО
100 г/мольCaCO 3 22, 4 л/моль СаО
х= 56 л
Оқушылардың іс-әрекеті
Оқушылар бүгінгі сабаққа қажетті құрал - жабдықтарын алады.
3- топқа бөлініп отырады.
Оқушылар тест тапсырмаларына жеке жауап береді. Берілген жауап нәтижесі бойынша өзін-өзі бағалайды.
Әр топ мүшесі есепті дербес шығарып ортақ қортынды жасауы қажет
Оқушылар тақырып пен жаңа ұғымдарды жазып алады. Берілген мәтінмен таныса отырып, топ ішінде талқылайды. Талқыланған жұмысты топ қорғайды.
Оқушылар жеке жұмыс жасайды.
Орындалған жұмыстарды топ ішінде талқылайды. Жұмыстарының дұрыс немесе бұрыс екеніне көз жеткізеді.
Оқушылар жаңа тақырып бойынша білімдерін көрсетеді
Сабақ рефлексиясын жазады
М: Бүгінгі сабаққа белсенді қатысқан, есеп шығарып, сұрақтарға жауап берген оқушылар түгелдей
бағаланды. Сабақ аяқталды, сау болыңыздар!
«Кім көп біледі ?»
- Металдар периодтық жүйеде қалай орналасқан?
А. Сол жағы төменгі бөлігінде Ә. Оң жағы жоғары бөлігінде
Б. Оң жағы төменгі бөлігінде
- Металдар арасындағы химиялық байланыс пен кристалл торы
А. Металдық байланыс металдық кр. торы
Ә. Металдық байланыс иондық кр. торы
Б. Иондық байланыс металдық кр. торы
- Металдар қандай қасиет көрсетеді
А. Тотықтырғыш Ә. Тотықсыздандырғыш Б. Екеуінде
- Қосымша топшада тек . . . орналасқан
А. Металдар Ә. Бейметалдар Б. Металдар, бейметалдар
- Металдардың сыртқы энергетикалық деңгейінде . . . - ке дейін электрон ғана болады А. 4 - 8Ә. 1-8Б. 1-3
- Электрохимиялық кернеу қатарында тотықсыздандырғыштық қасиеті
А. Кемиді Ә. Артады Б. Артады, сосын кемиді
- Металдардың активтік қатарын жасаған ғалым
А. Бекетов Н. Н. Ә. Ломоносов М. В. Б. Менделеев Д. И.
- Металдардың активтің қатары қай жылы ашылды
А. 1785 Ә. 1682 Б. 1865 ж
- Сумен әрекеттеспейтін металдар А. Алтын, күміс, сынап
Ә. Калий, нарий, литий Б. Алюминий, мырыш, темір
- Табиғатта қосылыс түрінде де, бос күйінде де кездеседі
А. Калий, нарий, литий Ә. Алтын, күміс, сынап
Б. Алюминий, мырыш, темір
- Қыздырғанда тотығады А. Алтын, күміс, сынапӘ. Калий, нарий, литий
Б. Алюминий, мырыш, темір
- Сумен қыздырғанда әрекеттеседі А. Калий, нарий, литий
Ә. Алтын, күміс, сынап Б. Алюминий, мырыш, темір
«Кім көп біледі ?»
- Металдар периодтық жүйеде қалай орналасқан?
А. Сол жағы төменгі бөлігінде Ә. Оң жағы жоғары бөлігінде
Б. Оң жағы төменгі бөлігінде
- Металдар арасындағы химиялық байланыс пен кристалл торы
А. Металдық байланыс металдық кр. торы
Ә. Металдық байланыс иондық кр. торы
Б. Иондық байланыс металдық кр. торы
- Металдар қандай қасиет көрсетеді
А. Тотықтырғыш Ә. Тотықсыздандырғыш Б. Екеуінде
- Қосымша топшада тек . . . орналасқан
А. Металдар Ә. Бейметалдар Б. Металдар, бейметалдар
- Металдардың сыртқы энергетикалық деңгейінде . . . - ке дейін электрон ғана болады А. 4 - 8Ә. 1-8Б. 1-3
- Электрохимиялық кернеу қатарында тотықсыздандырғыштық қасиеті
А. Кемиді Ә. Артады Б. Артады, сосын кемиді
- Металдардың активтік қатарын жасаған ғалым
А. Бекетов Н. Н. Ә. Ломоносов М. В. Б. Менделеев Д. И.
- Металдардың активтің қатары қай жылы ашылды
А. 1785 Ә. 1682 Б. 1865 ж
- Сумен әрекеттеспейтін металдар А. Алтын, күміс, сынап
Ә. Калий, нарий, литий Б. Алюминий, мырыш, темір
- Табиғатта қосылыс түрінде де, бос күйінде де кездеседі
А. Калий, нарий, литий Ә. Алтын, күміс, сынап
Б. Алюминий, мырыш, темір
- Қыздырғанда тотығады А. Алтын, күміс, сынапӘ. Калий, нарий, литий
Б. Алюминий, мырыш, темір
- Сумен қыздырғанда әрекеттеседі А. Калий, нарий, литий
Ә. Алтын, күміс, сынап Б. Алюминий, мырыш, темір
«Мен кіммін ?»
- топ. Тотығу дәрежесі +2 - ге тең, 8 гр металл сумен реакцияласқанда 4, 48л сутегі
(қ. ж. ) бөлінді. Металдың молярлық салмағын анықтап, оны атаңыз.
2-топ. Массасы 5 г сілтілік жер металы ауадағы оттекпен тотықтырылған. Алынған
оксид сумен әрекеттескенде массасы 9, 25 г металл гидроксиді түзілген. Қандай
сілтілік жер металы алынған?
3-топ. 4г екі валентті металл броммен әрекеттескенде оның 20г бромиді алынған. Бұл
қандай металл екенін анықтаңдар.
Эксперименнттік бөлім.
I топ тапсырмасы:
8 сыныптағы «Д. И. Менделеевтің заңы мен жүйесі» тақырыбынан алған теориялық білімдеріңізге сүйеніп, кальций элементіне сипаттама беріңіздер. (Периодтық жүйе пайдаланылады)
II топ тапсырмасы:
Кальцийдің химиялық қасиеттерін сипаттайтын мына рекция теңдеулерін аяқтаңыздар.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz