Химияда есеп шығаруды оқытудың методикасы: кері есептер, алгоритмдік тәсілдер және оқыту кезеңдері


Есепті кері шығару арқылы оқушылар жұмыс жасауда қанағаттанарлық сезімін оятатын оның шешуінің дұрыс екендігін тікелей көрсететіндігіне көз жеткізеді.
Тағы бір маңызды белгісі -оқушылардың есепті тура кері шығарудың жолын құруы. «Есептерді оқушылардың құруы - материалды меңгергенін анықтайтын тәсілдің бірі».
Оқушылар есепті кері шығарудың бірнеше нұсқасын құруы мүмкін. Бірте-бірте оқушыларға құралған есептерді күрделендіре беру қажет. № 11-51 есептерін шығарғаннан кейін оқушыларға күкірт (ІҮ) оксиді массасын 32, 40, 80, 160 және т. б. дейін өзгертіп жаңа есеп құрау ұсынылады. Қашан оқушылар осы есептерді толық меңгергенше, есепті түрлендіріп, кері есеп шығару арқылы қышқылмен әрекеттесу арқылы 63, 126, 189 г натрий сульфатының түзілуінен күкірт (ІҮ) оксидінің массасын анықтауды ұсыну қажет.
Кейіннен, өте күрделі этап бойынша мұғалім есептің берілуі мен зат формулаларын және реакция теңдеулерін жазып беру арқылы орындауды ұсынады:
а) m (Al 2 O 3 ) = 20, 4
m(Al) - ?
б) m (P 2 O 5 ) = 284 Р + О 2 → P 2 O 5
m(P) - ?
Оқушыларға есептің берілгенін әр түрлі нұсқаларды қолданып жазбаша түрде жазу ұсынылады және оны әр түрлі тәсілдермен ең оңтайлы тәсілін көрсетіп орындау ұсынылады.
Сонымен, мұғалім нақты химиялық процесті сипаттайды немесе кітап бойынша жазбаны қолдану арқылы затты атайды. Оқушылар есептердің тура және кері шығарылу жолдарын реакция теңдеулерін қолдана отырып шығаруы керек. Мысалы, 77-беттегі мыс (ІІ) оксидінің күкірт қышқылы ерітіндісімен әрекеттесу реакциясын қарастыруға болады.
Сонан соң оқушылар өлкетанулық материалдар негізінде пәнаралық және пәнішілік байланыстар орната отырып тапсырмалар құруын ұсынуға болады.
Методикалық жолдарды қолдану оқушы бойында әр түрлі химиялық есептерді өз бетінше құрастыруды қалыптастыруда және оқушыларда есеп шығару алдында болатын «психологиялық жайлылық» тудыруда маңызды рөл атқарады.
«Психологиялық жайлылық» жағдайы бірнеше кезеңде орнайды. Бастапқыда мұғалім сыныппен бірге белгілі бір типтегі есептің шешуін оның шешу жолдарын көрсете отырып жан-жақты талқылайды. Түсіндіргеннен кейін сыныптағы барлық оқушыларға қиындық деңгейі бірдей ұқсас есептерді шығару және қиындық деңгейі ұқсас кері есеп құрастыру ұсынылады. Оқушылар бұл есептерді мектепте де, үйде де шығарады. Есепті шығарудың сапасы мен жіберілген қателіктермен жұмыс жасалады. Сонан соң оқушыларға әр түрлі есептерді өз беттерінше есеп шығару ұсынылады.
Оқытудың қорытынды кезеңінде мұғалім оқушылар өз деңгейлеріне қарай таңдап шығаратын әр түрлі есептерден, есеп саны әр түрлі болуы мүмкін (есеп кітаптан нөмірі көрсетіліп) тізім құрады. Міндетті талап ол оқушылардың дәптерін тұрақты тексеріп тұру болып табылады. Оқушылардағы мұндай жұмыстың нәтижесі қиындықтарды жеңудегі интеллектуалдық қанағаттанудың пайда болуына алып келеді.
§2. Есеп шығаруды оқытудың методикалық принциптері
Есеп шығаруды оқыту процесі қалыпты жағдайда өтеді және келесідей методикалық принциптер қатарын сақтаған жағдайда қанағаттанарлық деңгейге жетеді: 1) біріншіден мұғалім есепті өзі шығарады және есепді талқылау методикасын ойлап табады; 2) оқушылар жиі есеп жазбасын көруі тиіс; 3) оқушылар есеп шығару барысында өзіндік қабілетін көрсетуі керек; 4) оқушыларға есеп шешуін тексеру арқылы өзіндік талдау жасау керек; 5) мұғалім химияны оқыту процесі кезінде есептерді шығаруды жүйелі іске қосу қажет.
Әрбір мұғаліммен сабақта немесе үйге шешуге берілген есеп алдымен олардың арасында шығарылуы керек, сонымен қатар есептің химиялық жағы нақты қарастырылуы керек және ол 2-3 оңтайлы шешу жолын таңдау арқылы шығарылуы тиіс. Бұл мұғалімді есептің шығарылуын түсіндіру кезінде оларды бұрыс бағытта жүруіне көмектеседі. Сабаққа дайындық кезінде түсіндіру барысында «қысқа тұйықталу» және интерференцияның алдын алу үшін оқушылардың қандай біліктерін қолдана алатынын ескеріп алған жөн.
Мұғалімнің еңбек ісін ұйымдастырудың ғылыми мақсатында есептер картотекасын құрған абзал, яғни әр есепті бөлек картотекада шығару керек, қолдану ыңғайына қарай нөмірленіп белгіленеді. Жасалған картотека есептерді шешуді қайталауға немесе оны ұзақ уақыт іздеуге мұғалімнің уақытын шығындамайды. Оқушылардың өздігінен картотекаға жазуы кезінде олардың жазбаша түрін белгілі өлшемде жазу ұсынылады және бұл карточкаларды тексергеннен кейін оларды оқушылардың жеке жұмысы ретінде кабинетте сақтаған жөн.
Бастысы есеп жазбасы оқушылардың көз алдында жазылуы мен шығарылуы қатар жүргізіледі. Іс жүзінде мұны химия кабинетіндегі есеп жинақтарынан; оқулықта да, есептер жинағында да болмаған жағдайда есеп жазбасын экранға шығару арқылы; тақтаға жазу арқылы есептің жазбасын жаздыруды іске асыруға болады.
Есептің берілгенінің жазбасын жазу мақсатында есепте маңызды ұғымдар мен ізделінетін мәндер беріледі. Сабақта уақыт өткізетін тұстардың бірі осы есеп жазбаларын мұғалімнің ауызша айтып жаздыруы, ал бұл уақыт аралығында бірнеше есепті шығарудың жолдарын қарастыруға болады.
Есепті шығару кезінде оқушылардың өзіндік ынтасы мен реттелуін есепке алған жөн. Есепті дамыту эффектісі жоғалады, оқушылардың есеп шығаруға қызығушылығы төмендейді, егер есептің шешуі мұғалімнің айтуы бойынша жүрсе, онда оқушылар жұмыс жасамайды, тек тақтадағы жазбаны дәптерге көшірумен болады. Аталған педагогикалық шырмауды болдырмау үшін оқушыларды есеп шығару кезінде жиі араластырып отыру керек. Бұл мақсатта оқушыларды оқыту процесі бірнеше кезең бойынша жүзеге асырылады. Бастапқыда мұғалім оқушыларға есептің шығарылуын есепті зерттеу мен берілгенін жазуды, реакция теңдеулерін көрсете отырып есеп шығару барысында оны шығару жоспарын құратындығын айтып жете түсіндіреді. Нақты талаптарға сәйкес (сынып белсенділігінің дәрежесі, теориялық дайындық деңгейі) мұғалім есептің математикалық бөлігіне қолданылатын тәсілдердің бір немесе екі оңтайлы түрлерін қолданып, шығарылуы мен жауап жазбасын өрнектеуді көрсетеді.
Шешуі оқушыларға түсінікті болып дәптерге жазылғаннан кейін, оқытудың келесі деңгейі - барлық сыныптардағы есеп шығарудың фронтальды тәсіліне көшеді. Әңгімелесу әдісі бойынша есептің берілгені, талдау және жоспары жазылады. Мұғалім оқушылардың ойлауын есепті шығарудың оңтайлы тәсіліне бағдарлайды, ал есептің шешімін өз беттерінше жазу талап етіледі.
Келесі кезең шығарылған есептің кері түрін құру болып табылады. Бұл жағдайда өзіндік есептерді құрылымдау - есеп шығаруды үйренудің бірден-бір дұрыс әдіс-тәсілдерінің бірі. Жекелей шығармашылық жұмыстан кейін жазбалардың ішіндегі сәтті шыққандығын топпен талдау жасау арқылы талдау жүргізіледі. Бұл есепті өз беттерінше шығару ұсынылады.
Есеп шығарудың бұл типінде оқушылар толық өз бетінше жұмыс жасайды. Өзіндік жұмыс жасауды қалыптастыру үшін мұғалім әр түрлі методикалық тәсілдерді қолдана алады. Оқытудың алғашқы кезеңіндегі оқушының өзіндік жұмысын тексеру алдыңғы шығарылған есеппен немесе тақтада жазылған, экран бетінен көрсетілген есептің шығарылуымен салыстырылады.
Оқушылардың шығармашылық белсенділігін арттыру үшін есеп шығару кезінде үздіксіз оқу білігін қалыптастыру керек. Мұны қалай жасайды? Ғалым, инженер, химиялық кәсіптің технологы, экономист, суретші-дизайнер және т. б. өндірістік тапсырмалардың шешімін табуда екіншілік мақсаттарды орындауға айрықша көңіл бөлу керек, соның ішінде есептің шығарылуы жалпылама, әдемі және тиімді болуы керек.
Есеп шығару - бұл басты мәселе емес, бастысы есепке байланысты химиялық түсініктерді түсіну немесе жаңа материалдарды игеру, ойлаудың жаңаша қырларын дамыту, яғни әрбір есеп жаңа білім мен білік меңгертуі керек. Сондықтан, есептің шешімін дұрыс табумен есеп шығарылуы дұрыс деп есептеуге болмайды. Оқушы бұл шешімді қалай шығарғанын тексеру қажет. Бұл есептің жауабын табу үшін қандай білімін қолданды? Есепті шешудің басқа да жолдары да бар ма? Есепті шешудің басқа да оңай жолдары бар ма? Ол өзінің шешу жолының дұрыстығын дәлелдей алады ма, яғни өз шешімін тексере ала ма?
Осылайша, оқушыларды есепті шығару барысында өзін-өзі тексеруі - оларды шешу жолын талдау білігіне, өз іс-әрекетін үнемі қадағалауы деген сөз, келесідей сұрақтарға ойша жауап беруі керек: есептің шешу жолы дұрыс па? Дұрыс жолды дәлелдеуге бола ма? Есептің шешуі химия, физика, математика заңдары мен ережелеріне сәйкес пе? Есеп шығарудың орынды тәсілі қолданылған ба? Мұнан да оңай жолдар арқылы шешуге бола ма? Есеп жауабының дұрыс екенін қандай тәсілмен дәлелдеуге болады?
Оқушыларды шешімін өзіндік талдау жолдарына бағдарлау кезінде мұғалім жоғарыда аталған сұрақтарды қоюмен қатар оқушылардың өз есепті шешу жолын сынып алдында қорғауға және оқушы мен оқушы арасында тексеруді ұйымдастыруына оларды итермелеу керек.
Мұғалімнің оқушыларды есепті шығару кезінде ойлау процесін құруға, реттілікпен әрекет етуді, есеп берілгеніне сүйенуді үйретуге талпынуы оқытудағы есептерді шығарудың жаңа бағытына - есептерге алгоритмді қолдану химияға қызығушылықты арттыруға алып келді.
Есептің алгоритмдік жазбасын бірнеше қадамдар арқылы граф-схемамен көрсетуге болады.
Алгоритмдік жазба (№ 11-15 есептер үшін)
- Есептің шартын жазыңдар.
- Реакция теңдеуін жазыңдар.
- Реакция теңдеуі бойынша күкірт (ІҮ) оксидінің және натрий сульфидінің массасын есептеңдер.
- Күкірт (ІҮ) оксидінің есеп шартында берілген және теңдеу бойынша массасын салыстырыңдар.
- Натрий сульфитінің массасын есептеу.
- Есептің жауабын жаза.
Граф-схема есеп түрінде қарастырылғанда
Есеп шартының жазбасы → Реакция теңдеуінің жазбасы → Зат массасын есептеуге алдын ала әрекет ету → Зат массаларын салыстыру → Зат массасын есептеу → Есептің жауабы
Алгоритм бойынша №11-51 есептің шешуі
- Есеп шартының жазбасы:
m(SO 2 ) = 16 г
m(Na 2 SO 3 ) - ?
- Реакция теңдеуін жазу:
Na 2 SO 3 + H 2 SO 4 = Na 2 SO 4 + SO 2 ↑+ H 2 O
- Зат массасын есептеуге алдын ала әрекет ету:
M(SO 2 ) = 64 г/моль
m(SO 2 ) = 1 моль · 64г/моль = 64 г
M(Na 2 SO 3 ) = 126 г/моль
m(Na 2 SO 3 ) = 1 моль · 126 г/моль = 126 г
- Зат массаларын салыстыру:
16 г˂ 64г 4 есе, m(Na 2 SO 3 ) 4 есе аз мөлшерде қажет.
- Зат массасын есептеу:
m(Na 2 SO 3 ) = 126г ׃ 4 = 31, 5 г
- Жауабы. 16 г SO2алу үшін 31, 5 Na2SO3қажет,
яғни а) алгоритмді меңгергенмен, білмеуі мүмкін; б) алгоритмді біле отырп меңгеруіге болады; в) алгоритмді біле отырп, оны қолдана алмауы да мүмкін. «Алгоритмдік әдісті (қатал түрде - есеп шығарудың методикасына сәйкес - осылай жаса!) шығармашылық ойлауды қамтамасыз етпейді, екіншіден, барлық есептер үшін «типтік» алгоритмді құрауға болады. Көптеген есептер түрлі ойлар мен шығармашылықты талап етеді. Оқушылар алгоритмдердің көптүрлігінен шатасады, сондықтан әрбір есепке сәйкесінше алгоритм болу керек».
Есепті шығара білу білігінің жетістігі әрқашан бір есеппен басқа есеп арасында реттілікті сақтап оқу жылы бойы есептер жүйесін құру, жаңа материал өту кезінде оқушылардың білімінің дамуына негізделеді. Есептер өтілген тақырып пен сабақ материалдарымен тығыз байланыстап болу керек.
§3. Химия сабағында есептерді қолдану әдістемесі
Химияны оқытудың әдістерін түрлендіріп есептерді келесідей сабақ кезеңдерінде қолдануға болады: жаңа материалды өту кезінде; сабақта өтілген материалды бекіту кезінде; сабақта және үйде өзіндік жұмыс жасау кезінде; оқушылардың білімін тексеру кезінде; өтілген тақырыпты қайталау кезінде немесе бақылау жұмысында; оқушылардың тақырып бойынша білімдерді қорытындылауда.
Жаңа сабақты түсіндіру кезінде есептерді оқушылардың өтілген тақырыпты меңгеруі үшін, өтілген заңдар мен теорияларды өрнектеу үшін немесе заңдар мен қандай да бір теорияларды қорытындылау үшін қолданады.
Бұл ретте белгілі бір шарттарды ұстану керек. Есептің шарты нақты, көлемі жағынан шағын, барлық оқушылар үшін түсінікті, есептер күрделі шығарылуларды талап етпеуі қажет. Мысалы, альдегидтерді өтуді бастаған жағдайда, мұғалім әңгіме арқылы оқушыларға алдыңғы тақырыпта спирттер класын, енді қосылыстардың жаңа класын өтетіндерін түсіндіру керек.
1-есеп. Бұл кластың қарапайым қосылысының молекулалық формуласын есептеңдер, егер сутегі бойынша тығыздығы 15-ке тең, ал зат құрамы: 53, 3% оттегі, 40% көміртек және 6, 7% сутегіден тұрады.
Ш е ш у і:
d H2 = 15
ω (O) = 0, 533
ω (C) = 0, 400
ω (H) = 0, 067
Формула - ?
Есепті шығару кезінде заттардағы элементтердің массалық үлесінің формуласын
ω = қолданып әр элемент атомының санын есептеп алу қажет, бұдан n =
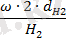 Mr = 2· d
H2
,
Mr = 2· d
H2
,
A
r
(O) = 16 n =
формуласы шығады.
A r (C) = 12
A r (Н) = 1
Формулаға сәйкес мәндерді қоя отырып, оқушылар әрбір элементтің атом санын анықтайды (есепті уақыт үнемдеу үшін келесідей тәсілдермен шығаруға болады) :
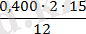
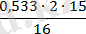 n(O) = = 0, 99 = 1; n(C) =
n(O) = = 0, 99 = 1; n(C) =
= 1;
n(H) = (0, 067·2·15) ׃ 1 = 2.
Алынған нәтижелерге сүйене отырып формула СН 2 О жазылады. Жауаптың дұрыс екендігін анықтау үшін оқушылар анықталған формуланың салыстырмалы молекулалық массасын анықтап, оны салыстырмалы тығыздық арқылы анықталған мәнмен салыстырады:
М r (СН 2 О) = 12+2+16 = 30; М r = 2d H2 ; М r = 2·15 = 30
Мұғалім жаңа органикалық қосылыстың қарапайым формуласы - СН 2 О екендігін ескере отырып, қарапайым спирттің формуласы - СН 4 О болатынын айтады. Оқушыларға осы екі формуланы салыстыруды және екеуінің ұқсастығы мен айырмашылығын айту ұсынылады. Оқушылар екі формула арасындағы айырмашылықтың сутек атомы сандарына байланысты екендігін айтып, яғни бұдан жаңа қосылыс спирттерді дегидрлеу арқылы алынатынын айтады:
- 2Н
СН 4 О СН 2 О
alcohol (dehydrogenization) → aldehyd
спирт (дегидрлену) → альдегид
Есеп шығару кезінде мұғалім оқушыларды «Альдегидтер» тақырыбын өтуге «альдегид» сөзінің мағынасын аша отырып дайындайды.
Қарапайым есептердің шешуін қолдана отырып мұғалім оқушылармен Авогадро заңын қорытындылауына болады.
2-есеп. 1 моль сутегі, оттегі және көмірқышқыл газы бар, егер осы газдардың тығыздығы келесідей: ρ(Н 2 ) = 0, 089 г/мл; ρ(О 2 ) = 1, 43 г/л; ρ(СО 2 ) = 1, 96 г/л болса, көлемін анықтаңдар.
Ш е ш у і:
V = m/ρ формуласын қолдана отырып, оқушылар 1 мольды құрайтын бөлшектердің массасы ретінде m мен М орнын ауыстырып есептеу жүргізеді:
М(Н 2 ) = 2 г/моль; М(О 2 ) = 32 г/моль; М(СО 2 ) = 44 г/моль.
V m (Н 2 ) = = 22, 4 л/моль;
V m (О 2 ) = = 22, 4 л/моль; V m (СО 2 ) = = 22, 4 л/моль
Алынған нәтижелерге сүйене отырып, оқушылар газдардың молярлық көлемі қалыпты жағдайда бірдей болады және 22, 4 л/моль көлем алады деп қорытындылайды. Әрі қарай мұғалім бірдей зат мөлшеріндегі әр түрлі газдар бірдей молекула сандарынан тұратындығын айтады және оқушыларға заңның тұжырымдамасын айтады: бірдей көлемде газдар қалыпты жағдайда бірдей молекула сандарын құрайды.
«Зат мөлшері», «моль» түсініктерін түсіндіру кезінде мұғалім алдымен «моль» түсінігіне анықтама береді және есептер қарастырады.
3-есеп. Зат мөлшері - мольде қанша құрам бөлшектері болады? 12 г көміртектің атомдар санын, 32 г оттегінің молекула санын, көміртек атомдары мен оттегі молекулаларының абсолютті массасын біле отырып есептеңдер:
m 0 (C) = 0, 2 · 10 -24 г және m 0 (О 2 ) = 53, 2 · 10 -24 г.
Ш е ш у і:
N A (C) = = 6·10 23 ; N A (О 2 ) = = 6·10 23
Осыған сәйкес, 1 моль зат 6·10 23 сол заттың құрам бөлшектерінен тұратындығын қорытындылайды.
Осылайша, тақырыпқа байланысты және тақырыпты толықтыратын есептер жаңа материалды оны түсінуге көмектесетін және оны игерудің негізгі бөлігі болып табылады.
Сабақта өтілген оқу материалын бекіте отырып, мақсатты репродуктивті жауаптарды шамалайтын сұрақтарды, меңгерілген білімді қолдануды қарастыратын есептермен алмастыру, оқушының өтілген тақырыпты түсінген, түсінбегенін дәл анықтауға мүмкіндік береді. Мысалы, оқушылармен газдардың молярлық көлемі мен Авогадро заңы түсініктерін қарастырып, келесі есептерді шығару керек:
4-есеп. 16 г оттегі, 1 г сутегі және 22 г көмірқышқыл газы (қ. ж. ) қанша көлем алады?
5-есеп. Газометрдегі 1) 11 г көмірқышқыл газы; 2) 8 г оттегі болатын әрбір газда қанша молекула болады?
6-есеп. Егер тығыздығы 1, 25 г/л болатын газдың молярлық массасын анықтаңдар?
Зат массасының сақталу заңынан кейін сабақты бекіту кезінде келесі есептерді оқушыларға ұсынуға болады:
7-есеп. Темір сульфидінің массасын анықта, егер реакция кезінде қалдықсыз 8 г күкірт пен 14 г темір әрекеттескен болса.
8-есеп. 56 кг СаО мен 4 кг көмірқышқыл газын СО 2 алу үшін қанша масса ізбестасты СаСО 3 ыдырату қажет.
Хлор қасиеттерін өту кезінде сабақты бекіту үшін келесі есептерді оқушыларға ұсынуға болады:
9-есеп. Құрамы 60% хлор мен 40% сутегіден (көлем бойынша) тұратын 1 л қоспаны қопарған. Хлорсутектің қандай көлемі пайда болуы мүмкін?
10-есеп. Неге 22, 4 л (қ. ж. ) хлор әрекеттесу үшін 2/3 моль темір немесе 1 моль мыс, 2 моль натрий қажет?
11-есеп. 3 көлем хлормен 2 көлем сутегі әрекеттесу тәжірибесін жүргізу кезінде хлорсутек шығыны 90% құрады. Алынған қоспа қандай көлем алады? (барлық өлшемдер бірдей жағдайда алынған) .
Ауызша есептеуге мақсатты түрде есептер беру оқушылардың ойының ұшқыр болуын, ынтасының пайда болуын, сабаққа қызығушылығының оянуын және оқушылардың белсенділігін арттырады.
Тәжірибелі мұғалімдер сабақ барысында өзіндік жұмыс ретінде және үйде бір-екі тапсырмаларды оқушылардың білігін арттыру үшін өтілген тақырып бойынша есептер береді. Бұл алдыңғы өтілген тақырыптарды үнемі жетілдіріп отыруға және игерілген білімді қолдана алу білігін қалыптастыруға мүмкіндік береді. Сонымен, VIII сыныпта «Бейорганикалық қосылыстардың негізгі кластары туралы мәліметтерді қорытындылау» 5-тақырыпты өту кезінде зат құрамын өткеннен кейін, оксидтер атауы, олардың классификациясы мен химиялық қасиеттерін мұғалім игерілген теориялық білімдер негізінде келесі типтегі есептерді шығару жолдарын қарастырады.
12-есеп. Құрамында 1, 5 моль зат мөлшері бар темір (ІІІ) оксиді берілген. Үлгінің массасын анықтаңдар.
13-есеп. 1, 12 л көлемдегі ыдыста көміртек (ІҮ) оксиді қ. ж. бар. Ыдыстағы заттың мөлшерін, молекула санын және оның массасын анықтаңдар.
14-есеп. Күкірт қышқылы ерітіндісімен 20г магний оксиді әрекеттескенде түзілген магний сульфатының массасын анықтаңдар.
15-есеп. 19, 7 г барий карбонатын алу үшін көміртегі (ІҮ) оксидінің қанша көлемін барий гидроксиді ерітіндісі арқылы өткізу қажет?
16-есеп. Күкірт (ІҮ) оксидінің және көміртек (ІҮ) оксидінің сутегі бойынша тығыздығын анықтаңдар.
17-есеп. Көміртек (ІҮ) оксиді, күкірт (ІҮ) оксидінің ауадан қайсысы жеңіл, қайсысыс ауыр екендігін анықтаңдар.
18-есеп. 14, 2 г фосфор (V) оксиді мен 50 мл сумен әрекеттескенде түзілген фосфор қышқылының массалық үлесін анықтаңдар.
Берілген тақырыптарды өткеннен кейін оқушылар алдыңғы өтілген тақырыптар туралы түсінік айтып өтеді. Оқушыларға жиі мынадай сұрақтар қойылады: заттар массасының сақталу заңы туралы айтып беріңдер, оттегінің қолданылуы туралы айтыңдар, судыі мәні туралы және өндірістегі, тұрмыстағы және ауыл шаруашылығындағы ерітінділер туралы айтып беріңдер және т. б. Бір түрдегі сұрақтарды жүйелі қолдану өтілген тақырыпты жаттап алуға алып келеді, өтілген тақырыпты шығармашылық тұрғыда түсінуін және тақырыпты ұғынуын дамытпайды. Жазбаша және эксперименттік есептерді шығаруда күрделендірген формада сұрауды қолдану оқушыларды параграфтың құрамын жаттап алуына, оқылғанның мағынасын түсінуіне көмектеседі. Мысалы, оқушылардың оттегі қосылыстарының жай заттармен реакцияларв туралы материалды қалай түсінгендігін тексеру үшін келесідей есептерді шығарту керек:
19-есеп. 1, 08 г алюминий оттегіде жанғанда түзілген алюминий оксидінің массасын анықтаңдар.
Бұл жағдайда есеп шығарудың мәні есептің сапалық жағына мән беру, дүниетанымдық көзқарасты қорытындылау болып табылады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz