Алюминий элементі: атом құрылысы, таралуы, физикалық және химиялық қасиеттері мен қолданылуы


Сабақтың тақырыбы: Алюминий
Сабақтың мақсаты:
Білімділік: Оқушыларға алюминий элементі, оның атом құрылысы, табиғатта таралуы,
физикалық, химиялыққасиеттері, қолданылуы, алюминий ионын анықтау
туралы білім беру.
Дамытушылық: Оқушылардың жеке элемент туралы көзқарасын дамыту,
алюминий элементі туралы тарихи деректерге тоқталып, халықтық
педагогика элементтерін сабақта пайдалану.
Тәрбиелілік: Білімді, өз елінің ұлтын, халқын, тілін, байлығын сүйетін ұлтжанды,
жастарды тәрбиелеу.
Сабақтың әдісі:
Сабақтың түрі:
Сабақта қолданылатын құрал-жабдықтар:
Сабақтың барысы:
Үй тапсырмасын тексеру:
Графиктік диктант арқылы тексеріледі: иә , жоқ деп оқушылар график сыза отырып, сұрақтарға жауап береді.
1. Сілтілік жер металдары табиғатта бос күйінде кездеседі.
2. Кальций ауадағы оттегімен әрекеттеспейтіндіктен, керосин астында сақтамайды.
3. Сілтілік жер металдары сутегімен әрекеттесіп, гидридтер түзеді.
4. Магний сумен баяу әрекеттеседі.
5. Сілтілік жер металдарының тотығу дәрежесі +2
6. Магний оксиді-екідайлы
7. Сөндірілген әктің формуласы- Ca(OH) 2
8. Дюралюминий құймасының құрамына магний кірмейді.
9. Кальцийді алғаш ашқан 1808ж Г. Дэви ашты.
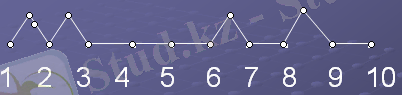 Жауап графигі былай бейнеленеді:
Жауап графигі былай бейнеленеді:
Сілтілік жер металдарының химиялық қасиеттерін қайталау мақсатында «сәйкестік тестісі» жұргізіледі:
2Ca+O 2 = CaH 2
Ba+2H 2 O= MgO+CO 2
MgCO 3 = 2CaO
Ca+H 2 = Ba(OH) 2 +H 2
CaO+H 2 O= CaCO 3 +H 2 O
Ca(OH) 2 +CO 2 = BeCI 2
Mg+S= Ca(OH) 2
Be+CI 2 = MgS
Толықтыруды қажет ететін тесті:
- Алғаш рет магнийді . . . ж . . . грек қаласы Магнезияның маңынан табылған минерал-ақ магнезиден алды.
- Кальцидің жетіспеуінен денсаулық зардап шекпеу үшін дені сау адам күніне . . . г кальций қабылдауы тиіс.
- Магний өсімдік клеткасындағы . . . құрамына кіріп, . . . үрдісінің жүруіне қатысады.
Таңдамалы тесті:
1) Ca→ CaO→ X айналу тізбегіндегі «Х» заты:
А) CaO Ә) Ca(OH) 2 Б) CaH 2
2) Э→ Э2O→ ЭОН айналу тізбегіндегі «Э» элементі:
А) Mg Ә) Ba Б) Na
3) Кальций сульфаты кристаллогидратының формуласы:
А) CaCI 2 Ә) CaSO 4 *2H 2 O Б) CaSO 3
Жаңа сабақты түсіндіру:
Жоспар:
1. Периодтық жүйедегі орны және атом құрылысы
2. Табиғатта таралуы
3. Өнеркәсіпте алынуы
4. Физикалық қасиеттері
5. Химиялық қасиеттері
6. Алюминийдің маңызды қосылыстары
7. Алюминий тұздарын анықтау
8. Қолданылуы
1. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы.
Алюминий - III топ, негізгі топша элементі, р - элемент. Алюминийдің жалғыз тұрақты изотопы 27 АІ бар. Сыртқы электрондық қабатының құрылысы-3s 2 3p 1, осыған байланысты алюминий +3 тотығу дәрежесін көрсетеді.
Электрондық формуласы: 1s 2 2s 2 2p 6 3s 2 3p 1
Алюминий химиялық реакцияларда 3 электрон беріп, өзінің тұрақты +3 тотығу дәрежесін көрсетеді:
AI 0 - 3e - AI 3+
Табиғатта таралуы:
Алюминий - белсенді болғандықтан табиғатта бос күйінде кездеспейді, ал қосылыстар құрамында ең көп таралған металл.
Оның жер қыртысындағы үлесі 9%. Жер қыртысында алюминий көптеген минералдар түзеді. Алюминийдің маңызды өнеркәсіптік кендері: боксит (AI 2 O 3 *nH 2 O), корунд (AI 2 O 3 ), каолинит (AI 2 O 3 *2SiO 2 *2H 2 O), ортоклаз (KAISi 3 O 10 ) . Елімізде алюминий кендерінің үлкен қоры Арқалықта (Қостанай облысы) бар. Сол кенді пайдаланып Павлодар алюминий зауыты жұмыс істейді.
Корундтың мөлдір қоспаларымен боялған кристалда белгілі: қызыл-рубин және
көк- сапфир, бұлар бағалы тас ретінде пайдаланады.
Өнеркәсіпте алынуы:
Алюминийді электролиз әдіспен алуға болады. Алюминий өндірісінде, шикізат ретінде көбінесе боскситтер жиі қолданады. Қыздырғанда олар суын жоғалтып, алюминий оксидіне айналады. Алюминий оксидінің балқу температурасы жоғары (2045 0 С) және ол электр тоғын өткізбейді. Сондықтан AI 2 O 3 -ті фторидтерді қоса отырып (CaF 2 , MgF 2 немесе AIF 3 ), балқытылған криолитте ерітеді. Бұл қоспа шамамен 1000 0 С температурада балқиды.
Электролиз кезінде катодта-алюминий, ал анодта -оттек бөлінеді. Электролиз реакциясының жалпы теңдеуі:
AI 2 O 3 электролиз → 2AI+1. 5O 2
Алюминий- жеңіл, күміс түстес ақ металл, оның тығыздығы - 2, 7 г/см 3 . Балқу температурасы - 660, 24 0 С, ал қайнау температурасы-2500 0 С. Алюминий иілгіштік қасиеті жоғары, оңай фольга болып жайылады және сым түрінде созылады.
Алюминийдің электрөткізгіштігі, жылуөткізгіштігі жоғары. Металдың беті жұқа және өте тығыз оксид қабықшасымен қапталған. Бұл қабықша оптикалық мөлдір және металдық шағылдырғыш қабілетін сақтайды.
I. Жай заттармен әрекеттесуі:
- Егер алюминий ұнтағын немесе жұқа алюминий фольгасын қатты қыздырсақ, онда олар тұтанады да көз қаратпайтын жалын түзе жанады:
4AI 0 +3O 2 0 =2AI 2 O 3
Алюминий басқа металдар сияқты бейметалдармен әсіресе ұнтақ түрінде жеңіл әрекеттеседі, реакция басталуы үшін, гологендер -CI және Br басқа, алдын ала қыздыруы қажет және көп мөлшерде жылу бөлінеді:
- 2AI0+3Br20=2AI+3Br3-1
- 2AI0+3S0=AI2+3S3-2
4AI 0 +3C 0 =AI 4 +3 S 3 -4
II. Күрделі заттармен әрекеттесуі:
- Электрохимиялық кернеу қатарында алюминий темірдің алдында орналасқан, белсенділігі жағынан сілтілік жер металдарға ұқсас. Егер қорғағыш қабықшаны химиялық әдіспен аластатса (мысалы, сілті ерітіндісімен), онда металл сумен сутек бөліп, қарқынды әрекеттеседі:
2AI + 6H 2 O = 2AI(OH) 3 + 3H 2
- Сұйылтылған тұз және күкірт қышқылдарымен әрекеттесіп, алюминий тотықсыздандырғыш болады:
2AI + 6HCI= 2AICI 3 + 3H 2
2AI + 3H 2 SO 4 = AI 2 (SO 4 ) 3 + 3H 2
- Алюминий сілтінің судағы ерітінділерінде алюминат тұзын түзіп, ериді:
2AI+2NaOH+6H 2 O=2Na│AI(OH) 4 │+3H 2
Алюминий (ІІІ) оксиді (AI 2 O 3 ) - екідайлы оксид, ақ түсті балқу температурасы өте жоғары зат, ол сәйкес гидроксидті қыздыру арқылы ыдырату барысында түзіледі:
2AI(OH) 3 =AI 2 O 3 +3H 2 O
Негіздік қасиеті қышқылдық қасиетіне қарағанда әлсіздеу:
AI 2 O 3 +6NaOH+3H 2 O=2Na 3 [AI(OH) 6 ]
AI 2 O 3 +6HCI=2AICI 3 +3H 2 O
Алюминий гидроксиді- AI(OH) 3 , мүлдем суда ерімейді және типтік екідайлы гидроксид болып табылады.
І. Алынуы: AICI 3 +3NaOH=AI(OH) 3 ↓+3NaCI
ІІ. Химиялық қасиеттері:
Қышқылмен: AI(OH) 3 +3HNO 3 =AI(NO 3 ) 3 +3H 2 O
Сілтімен: AI(OH) 3 +NaOH =Na[AI(OH) 4 ]
Алюминий тұздарын сілтілермен сапалық реакция бойынша анықтауға болады. Бұл кезде алюминий гидроксидінің қоймалжың тұнбасы түзіледі. Тұнба сілтінің артық мөлшерінде ериді.
AICI 3 +3NaOH=AI(OH ) 3 ↓+3NaCI
- AI - құймалар алуда, электротехникада электр сымдарын жасау үшін, жарылғыш заттар алуда, химиялық аппаратураларды дайындауда, құрлыстар салуда, ыдыстар жасауда т. б қолданылады.
- AI2O3- зергерлік істе, дәл аспаптарға (сағаттағы “тастар”) мойынтіректер мен тіректер, пластинка ойнағыштың басына дыбыс түсіргіш инелер жасайды.
- AICI3-алюминий хлоридін органикалық синтезде өршіткі ретінде;
- AI2(SO4) 3- алюминий сульфаты суды тазалауда және қағаз өндірісінде;
KAI(SO 4 ) 2 *12H 2 O - алюмокалий ашудасы тері, аяқкиім өнеркәсібінде теріні илеу үшін және маталарды бояғанда өңдеу үшін қолданады.
Жаңа сабақты бекіту есептері: 162 бет №5, 6, 7
№4
AI 2 (SO 4 ) 3 +6KOH(жетпегенде) =2AI(OH) 3 +3K 2 SO 4
2AI 3+ +3SO 4 2- +6K + +6OH - =2AI(OH) 3 +6K + +3SO 4 2-
2AI 3+ +6OH - =2AI(OH) 3
AI 2 (SO 4 ) 3 +2KOH(артық мөлшерде) +6H2O=2K[AI(OH) 4 ] +3H 2 SO 4
2AI 3+ +3SO 4 2- +2K + +2OH - +6H2O =2K[AI(OH) 4 ] +6H + +3SO 4 2-
2AI 3+ +2K + +2OH - +6H2O =2K[AI(OH) 4 ] +6H +
№5
AI →AICI 3 →AI(OH ) 3 →AI 2 O 3 →Na[AI(OH) 4 ] →AI 2 (SO 4 ) 3 →AI(OH ) 3 →AICI 3 Na[AI(OH) 4 ]
1. 2AI + 6HCI= 2AICI 3 + 3H 2
2. AICI 3 +3NaOH=AI(OH) 3 ↓+3NaCI
3. 2AI(OH) 3 =AI 2 O 3 +3H 2 O
4. AI 2 O 3 +2NaOH+3H 2 O=2Na[AI(OH) 4 ]
5. 2Na[AI(OH) 4 ] +4H 2 SO 4 = AI 2 (SO 4 ) 3 +Na 2 SO4+8H 2 O
6. AI 2 (SO 4 ) 3 +6KOH=2AI(OH) 3 +3K 2 SO 4
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz