Атом құрылысы, атом ядросының құрылымы және изотоптар


Сабақтың тақырыбы: Атом құрылысы. Атом ядросының құрылысы. Изотоптар
Сабақтың мақсаты: а) Білімділік мақсаты.
Атом құрылысы жайлы білімді нақтылау. Атом қабаттарына электрондарды толтыру заңдылығы, электрондық деңгейлер, олардың периодқа байланысты екенін түсіндіру.
ә) Дамытушылық мақсаты.
Материя құрылымдағы ортақ заңдылықтар туралы мағлұматтар бере отырып оқушылардың ой - өрісін дамыту.
б) Тәрбиелік мақсаты.
Оқушыларды еңбекке баулу, ерінбей көбірек ізденіп, өзіндік жұмыс орындауға тәрбиелеу.
Сабақтың көрнекі - құралдары.
Д. И. Менделеевтің жасаған химиялық элементтердің периодтық жүйесі (электрондық түрі), графопроектор, атом ядросының құрылысының суреті, сутектің изотоптары.
Сабақтың әдіс-тәсілдері.
Тірек-сызбаларды (слайдтарды ) қолдану, деңгейлеп, саралап оқыту технологиясын пайдалану.
Сабақтың байланысы : өмірмен, қазақ тілімен, физика пәнімен .
Сабақтың түрі - аралас сабақ.
Сабақтың барысы.
І. Ұйымдастыру бөлімі.
ІІ. Үй тапсырмасын тексеру.
№1 - перфокарта.
- Химиялық элементтерді екі топқа бөліп, металдар мен бейметалдар деп жіктеу неге негізделген?
- Химиялық реакцияны аяқтап, теңестіріп, қай типке жататынын анықтаңдар. Na + H2O =
№2 - перфокарта.
- І топ металдары не себепті сілтілік металдар деп аталады?
- Сілтілік металл - натрий оксиді мен гидроксидінің түзілу теңдеуін жазыңдар.
№3 - перфокарта.
- Галогендердің химиялық қасиетін айтып, сәйкес реакция теңдеулерін жазыңдар.
- Қандай бір реактивтің көмегімен: а) натрий хлориді, б) натрий бромиді, в) калий йодиді ерітінділерінен галогендерді ығыстыруға болады? Жауаптарыңды реакция теңдеуімен ділелдеңдер.
№4 - перфокарта.
- Айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар. Ca → CaO → Ca(OH) 2→ CaCl2
2) Мына элементтерді металдық қасиеттерінің өзгеруі бойынша
орналастырыңдар. Na, Cs, K, Li, Pb
ІІІ. Жаңа тақырыпты меңгерту жоспары.
1. Атом күрделі бөлшек.
2. Атом құрылысының «планеталық» моделін ұсынған ғалым.
3. Атом ядросының құрамы.
4. Изотоптар.
1911 жылы ағылшын ғалымы Э. Резерфорд атом құрылысының «планеталық» моделін ұсынды. Бұл модель бойынша атомның ортасында оң зарядталған ядро бар, ал оны электрондар айналып жүреді. Ядро құрамында оң зарядты бөлшек протоннан басқа, зарядсыз бөлшек - нейтрон болады.
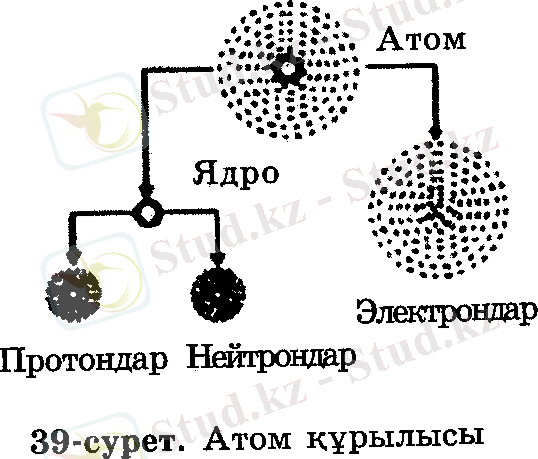
Электрон е (Аr = 0)
Нейтрон n (Аr = 1)
Протон Р (Аr = 1)
Химиялық элемент атомдарының ядро зарядтарының сандық мөлшері сол элементтердің периодтық кестедегі реттік нөмірлеріне тең болатындығы анықталған.
 (11р, 12n) 11 е
(11р, 12n) 11 е
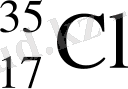 (17р, 18n) 17 е
(17р, 18n) 17 е
Атомның ядро заряды химиялық элементтің қасиеттерін сипаттайтын физикалық шама.
Аргонның оң заряды +18, калийдікі +19, сондықтан калий аргоннан кейін тұр.
Қазіргі уақытта периодтық заңның тұжырымдамасы былай оқылады: химиялық элементтер, олар түзетін жай және күрделі заттардың қасиеттері сол элементтердің атом ядроларының зарядтарына периодты түрде тәуелді болады.
Ядро зарядтары бірдей, бірақ салыстырмалы атомдық массалары әр түрлі болатын элементтер де бар.
Оқушылар изотоптарды оңай түсіну үшін төмендегі мысалмен айтуға болады.
Бір химиктің отбасында үш егіздер туылады.
Егіздер Изотоптар
жасы → 1 1 1 → ядро заряды (реттік нөмірі)
салмағы → 1 2 3 → атомдық масса
аты: протий дейтрий тритий
р = 1 р = 1 р = 1
n = 1 - 1 = 0 n = 2 - 1 = 1 n = 3 - 1 = 2
e = 1 e = 1 e = 1
Ядроларында протондар саны бірдей, бірақ массалары әр түрлі, белгілі бір элементті құрайтын атомдар түрін - изотоптар деп атайды.
( Изотоп грекше «бір орынға орналасушы» деген мағынаны білдіреді. )
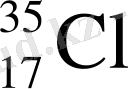 (17р 18n)
(17р 18n)
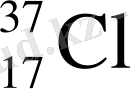 (17р 20n)
(17р 20n)
Изотоптар ядрозарядтары бірдей болғандықтан, оның электрондар саны да өзгермейді, сондықтан химиялық қасиеттері де бірдей.
Яғни, химиялық элемент дегеніміз - ядро зарядтары бірдей атомдардың белгілі бір түрі.
Табиғатта кездесетін хлордың 75, 53 % - і 35 Cl изотоптан және 24, 47 % - і 37 Cl изотоптан тұрады. Олай болса хлордың орташа атомдық массасы:
Аr (Cl) = 35
 0. 7553 + 37
0. 7553 + 37
 0. 2447 = 35. 453
0. 2447 = 35. 453
 35. 5
35. 5
Иодтың бір ғана изотопы бар
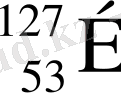 , ал теллурдың 6 изотопы бар, оның ішінде массасы үлкендеу -
128
Те және
130
Те изотоптары басым болып келеді. Сондықтан реттік нөмірі бойынша Теллур иодтан бұрын тұрса да, оның иодтан салыстырмалы атомдық массасы үлкен болып шығады.
, ал теллурдың 6 изотопы бар, оның ішінде массасы үлкендеу -
128
Те және
130
Те изотоптары басым болып келеді. Сондықтан реттік нөмірі бойынша Теллур иодтан бұрын тұрса да, оның иодтан салыстырмалы атомдық массасы үлкен болып шығады.
ІV. Сабақты бекіту.
І деңгей
1) Металдар қай қатарда орналасқан?
а) Na, Ca, K ; ә) Na, C, Mg; б) C, Cl, N; в) В, Са, Аl; г) Р, О, Рв
2) Бейметалдардың орналасу ретін көрсетіңіз.
а) Al, Na, Ca; ә) S, P, Si; б) Li, C, F; в) Na, Ca, K; г) Na, C, Mg;
3) Периодтық заң қай жылы тұжырымдалды?
а) 1969 жыл; ә) 1869 жыл; б) 1911 жыл; в) 1776 жыл; г) 1748 жыл
ІІ деңгей
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz